Vitamina C Dosis Niã±Os Gotas
Contenido
- Resumen
- Función
- Papel en la inmunidad
- Biodisponibilidad
- Deficiencia
- La IDR
- Prevención de Enfermedad
- Enfermedad cardiovascular
- Cáncer
- Diabetes mellitus tipo 2
-
Resultados adversos del embarazo
-
Enfermedad de Alzheimer
- Cataratas
- Gota
- Mortalidad
- Tratamiento de Enfermedad
- Enfermedad cardiovascular
- Sepsis
- Cáncer
- Resfriado común
- Asma
- Toxicidad del plomo
- Fuentes
- Alimenticias
- Suplementos
- Seguridad
- Toxicidad
- Cálculos renales
- Interacciones con drogas
- Daño oxidativo
- Recomendación del LPI
- Autores y Críticos
- Referencias
English
Resumen
- La vitamina C, también conocida como ácido ascórbico-L, es una vitamina soluble en agua. A diferencia de la mayoría de los mamíferos y otros animales, los humanos no tienen la capacidad de sintetizar la vitamina C y deben obtenerla de la dieta. (Más información)
- La vitamina C es un cofactor esencial en numerosas reacciones enzimáticas, p. ej., en la biosíntesis de colágeno, carnitina y neuropéptidos, y en la regulación de la expresión de genes. También es un potente antioxidante. (Más información)
- Los estudios de cohorte prospectivos indicaron que un mayor estado de vitamina C, evaluado por medio de la medición de la vitamina circulante, se asocia con riesgos menores de hipertensión, enfermedad coronaria y accidente cerebrovascular. (Más información)
- Existe cierta evidencia que sugiere que la vitamina C podría ser un complemento útil a la práctica médica convencional para reducir la lesión miocárdica y la arritmia después de un procedimiento cardíaco o cirugía en pacientes con enfermedad cardiovascular. (Más información)
- No hay datos suficientes para sugerir una relación entre el estado de la vitamina C y el riesgo de desarrollar un tipo determinado de cáncer. La mayoría de los estudios observacionales que examinaron la ingesta de vitamina C con relación a la incidencia de cáncer no encontraron alguna asociación. Ensayos controlados aleatorios no reportaron ningún efecto por parte de la suplementación de vitamina C en el riesgo de cáncer. (Más información)
- La evidencia actual de la eficacia de la vitamina C intravenosa en pacientes con cáncer se limita a los estudios observacionales, las intervenciones no controladas, y los reportes de casos. Existe la necesidad de ensayos clínicos de fase II grandes y de más larga duración que evalúen la eficacia de la vitamina C en la progresión del cáncer y la supervivencia general. (Más información)
- En general, el uso regular de suplementos de vitamina C acorta la duración del resfriado común, pero no reduce el riesgo de enfermarse. Tomar suplementos una vez que los síntomas del resfriado ya han comenzado no tiene beneficios comprobados. (Más información)
- Los suplementos de vitamina C están disponibles en muchas formas, pero hay poca evidencia científica de que una forma sea mejor absorbida o más efectiva que otra. (Más información)
- No hay evidencia científica de que grandes cantidades de vitamina C (hasta 10 gramos [g]/día en adultos) ejerzan efectos adversos o tóxicos. Se recomienda un nivel de ingesta superior de 2 g/día para evitar que algunos adultos experimenten diarrea y trastornos gastrointestinales. (Más información)
- La vitamina C suplementaria aumenta las concentraciones de oxalato en la orina, pero aún no se sabe si un aumento en el oxalato en la orina aumenta el riesgo de cálculos renales. Las personas predispuestas a la formación de cálculos renales pueden considerar evitar la suplementación con vitamina C en dosis altas (≥1 g/día). (Más información)
Función
La vitamina C (ácido ascórbico-L) es un potente agente reductor, lo que significa que dona electrones fácilmente a las moléculas receptoras (Figura 1). Con relación a este potencial de oxidación-reducción (redox), dos funciones principales de la vitamina C son como un antioxidante y como un cofactor de enzima (1).
La vitamina C es el principal antioxidante no enzimático, soluble en agua, en el plasma y los tejidos. Incluso en pequeñas cantidades, la vitamina C puede proteger a las moléculas indispensables para el cuerpo, como las proteínas, los lípidos (grasas), los carbohidratos y los ácidos nucleicos (ADN y ARN), del daño causado por los radicales libres y las especies reactivas de oxígeno (ERO) que se generan durante el metabolismo normal, por las células inmunitarias activas y por la exposición a toxinas y contaminantes (p. ej., ciertos medicamentos de quimioterapia y humo de cigarrillo). La vitamina C también participa en el reciclado de la reacción redox de otros antioxidantes importantes; por ejemplo, la vitamina C regenera la vitamina E de su forma oxidada (véase el artículo sobre la Vitamina E).
El papel de la vitamina C como un cofactor también está relacionado con su potencial redox. Al mantener metales unidos a enzimas en sus formas reducidas, la vitamina C asiste funciones mixtas de oxidasas en la síntesis de varias biomoléculas críticas (1). Estas enzimas son monooxigenasas o dioxigenasas (véase la Tabla 1). Los síntomas de la deficiencia de vitamina C, tales como la cicatrización deficiente de las heridas y el letargo, probablemente se deben al deterioro de estas reacciones enzimáticas dependientes de la vitamina C que conduce a la síntesis insuficiente de colágeno, carnitina, y catecolaminas (véase Deficiencia). Además, varias dioxigenasas involucradas en la regulación de la expresión de genes y el mantenimiento de la integridad del genoma requieren vitamina C como un cofactor. De hecho, la investigación ha descubierto recientemente el papel crucial que desempeñan las enzimas, como las TET dioxigenasas y las demetilasas de histonas con dominio de Jumonji, en el destino de las células y los tejidos (Tabla 1). Estas enzimas contribuyen a la regulación epigenética de la expresión de genes al catalizar reacciones involucradas en la desmetilación del ADN y las histonas.
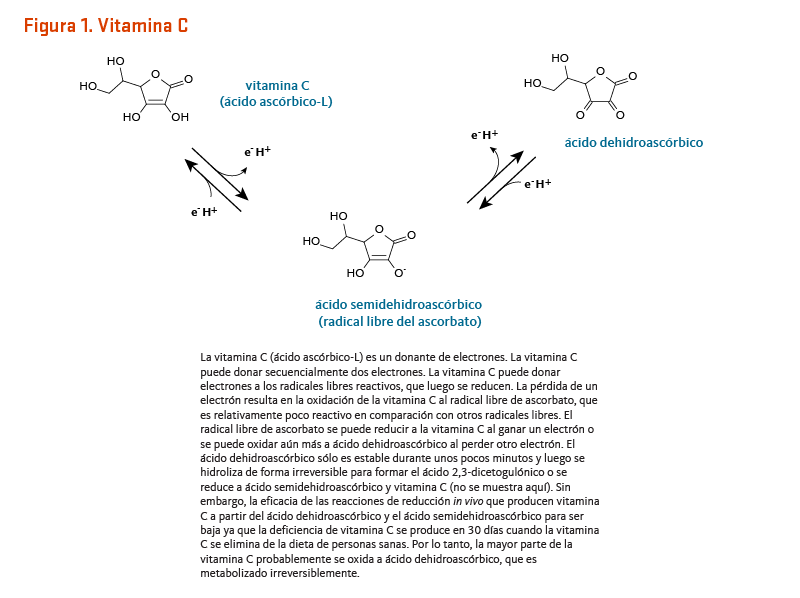
[Figura 1 - Clic para Agrandar]
| Enzimas* | Funciones |
|---|---|
| Monooxigenasas | |
| Dopamina β-monooxigenasa | Biosíntesis de Norepinefrina (Noradrenalina) |
| Peptildiglicano α-amidante monooxigenasa | Amidación de hormonas peptídicas |
| Dioxigenasas | |
| Isoenzimas 3 prolil 4-hidroxilasa | Hidroxilación del colágeno |
| Isoenzimas 3 prolil 3-hidroxilasa | Hidroxilación del colágeno |
| Isoenzimas 3 lisil hidroxilasa | Hidroxilación del colágeno |
| Isoenzimas del 4 factor inducible por hipoxia (HIF) | Hidroxilación de HIF |
| Hidroxilasa tri-metil-lisina | Biosíntesis de carnitina |
| Hidroxilasa γ-butirobetaína | Biosíntesis de carnitina |
| 4-Hidroxifenilpiruvato-dioxigenasa | Metabolismo de tirosina |
| Familia de dioxigenasas de translocación diez-once (TET) | Desmetilación del ADN |
| Demetilasas de histonas con dominio de Jumonji | Desmetilación de histonas |
| *Las monooxigenasas catalizan la hidroxilación de un sustrato, mientras que las dioxigenasas catalizan una reacción que acopla la hidroxilación de un sustrato específico con la conversión (descarboxilación) de α-cetoglutarato a succinato. | |
La capacidad de la vitamina C para influir en el estado de metilación del ADN y en las histonas en las células de los mamíferos apoya el papel de la vitamina en la salud y enfermedad más allá de lo que se entendía previamente, en particular salvaguardando la integridad del genoma (3, 4).
Papel en la inmunidad
La vitamina C afecta a varios componentes del sistema inmunológico humano in vitro; por ejemplo, se ha demostrado que la vitamina C estimula ambas producción (5-9) y función (10, 11) de leucocitos (glóbulos blancos), especialmente neutrófilos, linfocitos, y fagocitos. Medidas específicas de funciones estimuladas por la vitamina C incluyen motilidad celular (10), quimiotaxis (10, 11), y fagocitosis (11). Los neutrófilos, fagocitos mononucleares, y linfocitos acumulan vitamina C en altas concentraciones, las cuales pueden proteger estos tipos de células del daño oxidativo (12-14). En respuesta a microorganismo invasores, leucocitos fagocíticos liberan toxinas no específicas, como radicales superóxidos, ácido hipocloroso ("cloro"), y peroxinitrito; estas especies reactivas de oxígeno matan patógenos y, en el proceso, pueden dañarse los leucocitos también (15). Se ha demostrado que la vitamina C, a través de su funciones antioxidantes, protege los leucocitos de un daño oxidativo auto-infligido (14). Los leucocitos fagocíticos también producen y liberan citoquinas, incluyendo interferones, los cuales tienen una actividad antiviral (16). Se ha mostrado que la vitamina C aumenta la producción de interferones in vitro (17). Otros estudios han informado que la vitamina C mejora la capacidad de destrucción quimiotáctica y microbiana de los neutrófilos y estimula la proliferación y diferenciación de linfocitos B y T (revisado en 18).
El público en general piensa que la vitamina C estimula la función inmunológica, pero los estudios en humanos publicados hasta la fecha son conflictivos. Es probable que los resultados dispares se deban a problemas en el diseño del estudio, a menudo relacionados con una falta de comprensión de la farmacocinética y requisitos de la vitamina C (19, 20).
Finalmente, la vitamina C aumenta la biodisponibilidad del hierro de los alimentos al mejorar la absorción intestinal del hierro no hemo (véase el artículo sobre Hierro) (21).
Biodisponibilidad
Experimentos farmacocinéticos de eliminación y reposición demostraron que la concentración de vitamina C en el plasma está fuertemente controlada por tres mecanismos primarios: absorción intestinal, transporte en el tejido y reabsorción renal (22). En respuesta al incremento de dosis orales de vitamina C, la concentración de vitamina C del plasma se eleva abruptamente en ingestas entre 30 y 100 mg/día. La concentración de ascorbato en el plasma alcanzan un estado estable en concentraciones entre 60 y 80 micromoles/L (µmol/L). Esto se observa normalmente en dosis de 200 a 400 mg/día en adultos jóvenes sanos , con cierto grado de variación individual (23, 24).
Un cien por ciento de la eficacia en la absorción es observada cuando hay una ingesta de vitamina C en dosis separadas de 200 mg a la vez. Las dosis más altas (>500 mg) resultan en que se absorba la vitamina C fraccionadamente menos a medida que aumenta la dosis. Una vez que la concentración de vitamina C en el plasma alcanzan niveles de saturación, vitamina C adicional es excretada en gran parte por la orina. Notablemente, la administración de vitamina C vía intravenosa sobrepasa el control de absorción en el intestino de modo que se pueden alcanzar concentraciones alta muy altas de vitamina C en el plasma; dentro de unas pocas horas, la excreción renal restaura la vitamina C a las concentraciones basales del plasma (véase Tratamiento del Cáncer) (25).
Mientras que la concentración de vitamina C en el plasma refleja la ingesta dietética reciente, se cree que la vitamina C en los leucocitos (glóbulos blancos) es un indicador de las reservas corporales. Sin embargo, la concentración de vitamina en los leucocitos no refleja con precisión la vitamina C en varios tejidos y puede subestimar específicamente la captación de vitamina C en el músculo esquelético (26). No obstante, las concentraciones de vitamina C en el plasma ≥50 µmol/L son suficientes para saturar el tejido muscular en vitamina C.
También hay ciertas evidencias limitadas que sugieren que las personas que portan ciertos polimorfismos en los genes implicados en el transporte de la vitamina C y los mecanismos de desintoxicación pueden tener menores concentraciones de vitamina C en el plasma incluso con altas ingestas de vitamina C (véase también Complicaciones vasculares de la diabetes mellitus) (revisado en 27).
Debido a la farmacocinética y estrecha regulación de la vitamina C en el plasma, la suplementación con vitamina C tendrá efectos variables en vitamina C repleto (concentraciones de plasma cerca a la saturación) versus sub-óptima (concentraciones de plasma <50 µmol/L), ligeramente deficiente (concentraciones de plasma <23 µmol/L), o severamente deficientes (concentraciones de plasma <11 µmol/L) en individuos (28). Estudios científicos investigando la eficacia de la vitamina C para prevenir o tratar enfermedades necesitan evaluar el estatus de la línea de base de la vitamina C antes de embarcarse en una intervención o análisis estadístico (22, 29-31).
Para una discusión más detallada sobre la biodisponibilidad de diferentes formas de vitamina C, véase el artículo separado, La Biodisponibilidad de Diferentes Formas de Vitamina C.
Deficiencia
Una deficiencia severa de vitamina C ha sido conocida por muchos siglos como una enfermedad potencialmente fatal, el escorbuto. A finales de 1700, la marina Británica estaba consciente que el escorbuto podía curarse comiendo naranjas o limones, aunque la vitamina C no sería aislado hasta principios de 1930. Los síntomas del escorbuto incluyen hemorragia subcutánea, deficiencia en la cicatrización de heridas y fácil aparición de moretones, caída de cabello y dientes, y dolor e hinchazón en las articulaciones. Tales síntomas parecen estar relacionados con el debilitamiento de los vasos sanguíneos, tejido conectivo y óseo, los cuales contienen colágeno. Los síntomas iniciales del escorbuto, como fatiga, pueden ser el resultado de la disminución de los niveles de carnitina, la cual se necesita para derivar energía de la grasa, o de la disminución de la síntesis de catecolamina norepinefrina (véase Función). El escorbuto es raro en países desarrollados porque este puede ser prevenido con un mínimo de 10 mg de vitamina C diariamente (32). Sin embargo, han ocurrido casos en niños y ancianos con dietas muy restringidas (33, 34).
La Ingesta Diaria Recomendada (IDR)
La ingesta diaria recomendada (IDR) para la vitamina C está basado en la cantidad de vitamina C ingerida, necesaria para mantener la concentración de vitamina C en los neutrófilos con una mínima excreción urinaria de vitamina C y se propone que provee suficiente protección antioxidante (Tabla 2) (35). La ingesta recomendada para los fumadores es 35 mg/día más alta que para los no fumadores, porque los fumadores están sujetos a un incremento de estrés oxidativo por las toxinas en el humo de cigarrillo y generalmente tienen concentraciones más bajas de vitamina C (36).
| Etapa de la Vida | Edad | Machos (mg/día) | Hembras (mg/día) |
|---|---|---|---|
| Infantes | 0-6 meses | 40 (IA) | 40 (IA) |
| Infantes | 7-12 meses | 50 (IA) | 50 (IA) |
| Niños | 1-3 años | 15 | 15 |
| Niños | 4-8 años | 25 | 25 |
| Niños | 9-13 años | 45 | 45 |
| Adolescentes | 14-18 años | 75 | 65 |
| Adultos | 19 años y más | 90 | 75 |
| Fumadores | 19 años y más | 125 | 110 |
| Embarazo | 18 años y menos | - | 80 |
| Embarazo | 19 años y más | - | 85 |
| Período de lactancia | 18 años y menos | - | 115 |
| Período de lactancia | 19 años y más | - | 120 |
Prevención de Enfermedad
La cantidad de vitamina C requerida para ayudar a prevenir enfermedades crónicas es superior a la cantidad requerida para prevenir el escorbuto. La información con respecto a la vitamina C y la prevención de enfermedades crónicas está basada en ambos estudios cohorte prospectivos observacionales y ensayos controlados aleatorios (29, 37). Estudios de cohorte prospectivos pueden examinar la incidencia de una enfermedad específica con relación a la ingesta de vitamina C o el estado corporal en una cohorte de participantes que son seguidos a lo largo del tiempo. En contraste, los ensayos son estudios de intervención que pueden establecer una relación causal entre una exposición y un resultado, p. ej., al evaluar el efecto de la suplementación con vitamina C en la incidencia de enfermedad crónica en participantes aleatoriamente asignados para recibir ya sea vitamina C o placebo por una determinada duración de tiempo.
Enfermedad cardiovascular
Disfunción endotelial
La disfunción endotelial se considera como un paso temprano en el desarrollo de la aterosclerosis. Las alteraciones en la estructura y función del endotelio vascular que recubre la superficie interna de todos los vasos sanguíneos están asociados con la pérdida de la vasodilatación dependiente del endotelio mediada por el óxido nítrico normal. la disfunción endotelial resulta en la vasoconstricción generalizada y anormalidades en la coagulación. La medición de la dilatación mediada por flujo (DMF) de la arteria braquial es frecuentemente usada como un marcador funcional de la función endotelial; los valores de la DMF están inversamente correlacionados con el riesgo de eventos cardiovasculares futuros (38). Un meta-análisis del 2014 de 44 ensayos controlados aleatorios en sujetos con o sin enfermedades crónicas resumió el efecto de la vitamina C suplementaria en la función endotelial midiendola DMF (19 estudios), evaluando el flujo sanguíneo del antebrazo (20 estudios), o mediante análisis de onda de pulso (5 ensayos) (39). Se encontró que la suplementación a corto plazo con vitamina C reduce la función endotelial en sujetos con falla cardíaca, aterosclerosis o diabetes mellitus, pero no tuvo efecto en aquellos con hipertensión. La vitamina C también limitó la función endotelial que se indujo experimentalmente en voluntarios sanos (39). Se observó una mejora en la función endotelial con dosis diarias de vitamina C por encima de 500 mg (39).
Hipertensión
La hipertensión es un factor de riesgo importante para las enfermedades cardiovascular, incluyendo la enfermedad coronaria, el accidente cerebrovascular y la fibrilación auricular. Un análisis que combinó datos de tres cohortes, grandes, independientes, prospectivas, (1) Estudio de Salud de Enfermeras I (NHS1, por sus siglas en inglés; 88,540 mujeres, edad media de 49 años); (2) Estudio de Salud de Enfermeras 2 (NHS2; 97,315 mujeres, edad media de 36 años); y (3) Estudio de Seguimiento de Profesionales de la Salud (HPFS, por sus siglas en inglés; 37,375 hombres, edad media de 52 años), no encontró asociación entre el nivel de ingesta de vitamina C y el riesgo de desarrollar hipertensión (40). Por otra parte, cuando se midió la concentración de vitamina C en el plasma, los estudios transversales han indicado consistentemente una relación inversa entre la concentración de vitamina C en el plasma y la presión arterial tanto en hombres como en mujeres (41-43). Un seguimiento de 15 años de aproximadamente 2,500 participantes en el estudio de Desarrollo de Arterias Coronarias en Adulto Jóvenes (CARDIA, por sus siglas en inglés) encontró que una mayor cantidad de vitamina C en plasma y una puntuación de calidad dietética más alta se asociaron de forma independiente con un menor riesgo de desarrollar hipertensión (44).
Curiosamente, no hubo relación entre la puntuación de la dieta y el riesgo de hipertensión en aquellos con la vitamina C en plasma más baja, y la vitamina C en plasma se asoció positivamente en las personas con puntuaciones bajas en la dieta (44).
Un meta-análisis de 29 ensayos controlados aleatorios pequeños de corta duración (duración media, 8 semanas) en 1,407 participantes (10 a 120 sujetos por ensayo; incluidos sujetos normotensos e hipertensos) encontró que la suplementación con 60 a 4,000 mg de vitamina C (dosis media, 500 mg) redujo la presión arterial sistólica en 3.84 mm Hg y la presión arterial diastólica en 1.48 mm Hg (45). Se necesitan ensayos a largo plazo de buena calidad para examinar si el efecto antihipertensivo de la vitamina C se mantiene a lo largo del tiempo y eventualmente resulte en un riesgo reducido de eventos cardiovasculares.
Es importante que las personas con presión arterial significativamente elevada no se basen únicamente en los suplementos de vitamina C para reducir su hipertensión. En su lugar, deben buscar o continuar el tratamiento con medicamentos antihipertensivos y hacer cambios en la dieta y el estilo de vida, en consulta con su proveedor del cuidado de la salud.
Riesgo de enfermedad cardiovascular
La enfermedad coronaria (EC) está caracterizada por la acumulación de placa dentro de las arterias que suministran sangre al corazón (aterosclerosis). Después de años de acumulación y daño a las arterias coronarias, la EC puede culminar en un infarto del miocardio o ataque al corazón. Muchos estudios de cohorte prospectivos han examinado la relación entre la ingesta de vitamina C por la dieta y suplementos y el riesgo de padecer enfermedad coronaria, de los cuales los resultados han sido agrupados y analizados en dos análisis diferentes (46, 47). En el 2004, un análisis combinado de nueve estudios de cohorte prospectivos encontró que la ingesta de vitamina suplementaria (≥400 mg/día en un promedio de 10 años), pero no la ingesta dietética de vitamina C, estaba inversamente asociada con riesgo de EC (46). Al contrario, un meta-análisis del 2008 de 14 estudios de cohorte concluyeron que la ingesta dietética, pero no suplementaria, de vitamina C estuvo inversamente relacionada con el riesgo de EC (47). El estudio prospectivo grande más reciente de cohorte encontró una asociación inversa entre la ingesta dietética de vitamina C y la mortalidad de EC en mujeres japonesas, pero no en los hombres (48). A pesar de la variable asociación dependiente de la fuente, estos análisis indican una asociación inversa generalizada entre las altas ingestas de vitamina C y el riesgo de EC.
Las limitaciones inherentes a la metodología de evaluación dietaría, tales como sesgo de recuerdo, errores de medición, y confusión residual, pueden contar como algunas de las asociaciones inconsistentes entre la ingesta de vitamina C y el riesgo de padecer la EC. Para superar tales limitaciones, algunos estudios prospectivos midieron las concentraciones de vitamina C en plasma y suero como un índice más confiable de la ingesta de vitamina C y un biomarcador del estatus de vitamina C en el cuerpo.
El Estudio Prospectivo Europeo sobre Dieta y Cáncer (EPIC), un estudio de cohorte prospectivo de Norfolk, investigó la relación entre el estatus de la vitamina C e incidentes de insuficiencia cardíaca en adultos sanos (9,187 hombres y 11,112 mujeres, entre 58.1+/-9.2 years) (49). Después de un promedio seguido de 12.8 años, la vitamina C del plasma estuvo inversamente asociada con incidentes de casos de insuficiencia cardíaca. Específicamente, la vitamina C del plasma oscilaba entre aproximadamente 23 to 70 µmol/L en los hombres y 33 to 82 µmol/L en las mujeres; a través de este rango, cada 20 µmol/L de incremento de la vitamina C en el plasma se asoció con una reducción en 9% del riesgo de insuficiencia cardíaca. Auto-informes del consumo de frutas y verduras; evaluado por cuestionarios de frecuencia de alimentos — no se asoció con un riesgo menor de insuficiencia cardíaca congestiva (49). Esto resalta el hecho de que las limitaciones asociadas con los métodos de evaluación como los cuestionarios de frecuencia de alimentos, se pueden superar mediante el uso de biomarcadores de la ingesta de nutrientes (50, 51).
Una revisión de 2017 de ocho ensayos controlados aleatorios publicados encontró resultados inconsistentes de siete ensayos que informaron sobre el efecto de la suplementación con vitamina C en el colesterol sérico y triglicéridos, estableció factores de riesgo de enfermedad cardiovascular (52). Sólo un ensayo grande en más de 14,000 hombres mayores que participó en el Estudio de la Salud de Médicos II (PHS II, por sus siglas en inglés) reportó sobre los resultados cardiovasculares. El PHS II encontró que la suplementación con vitamina C (500 mg/día) durante un promedio de ocho años no tuvo un efecto significativo en mayores eventos cardiovasculares, infarto total al miocardio, o mortalidad cardiovascular (53). Notablemente, este estudio tuvo varias limitaciones (54), incluyendo la medición del nivel de vitamina C y el reclutamiento de una población adecuadamente nutrida.
Se necesitan estudios de mejor calidad para examinar el efecto de la vitamina C en los puntos finales cardiovasculares con riesgo elevado de enfermedad cardiovascular.
Accidente cerebrovascular
Un evento cerebrovascular, o accidente cerebrovascular, se puede clasificar como hemorrágico o isquémico. El accidente cerebrovascular hemorrágico ocurre cuando un vaso sanguíneo debilitado se rompe y sangra en el tejido cerebral circundante. El accidente cerebrovascular isquémico ocurre cuando una obstrucción dentro de un vaso sanguíneo bloquea el flujo de sangre al cerebro. La mayoría (~80%) de los eventos cerebrovasculares en países de altos ingresos son de naturaleza isquémica y se asocian a la aterosclerosis como una condición subyacente (55, 56).
Con respecto a la vitamina C y la enfermedad cerebrovascular, un estudio de cohorte prospectivo que siguió a más de 2,000 residentes de una comunidad rural japonesa durante 20 años encontró que el riesgo de accidente cerebrovascular en aquellos con las concentraciones de suero de vitamina C más altas fue 29% más bajo que en aquellos con las concentraciones de suero de vitamina C más bajas (57). De manera similar, el Estudio Prospectivo Europeo sobre Dieta y Cáncer (EPIC)-Norfolk, un estudio de cohorte prospectivo de 10 años en 20,649 adultos, encontró que los individuos con concentraciones de vitamina C en el plasma en el cuartil superior (25%) tuvieron un 42% menos riesgo de accidente cerebrovascular en comparación con aquellos en el cuartil más bajo (≥66 µmol/L vs. <41 µmol/L) (58). Tanto en la población japonesa (57) como en el Estudio Prospectivo Europeo sobre Dieta y Cáncer (EPIC)-Norfolk (58), las concentraciones de vitamina C en la sangre estuvieron altamente correlacionadas con la ingesta de frutas y verduras. Por lo tanto, como en muchos estudios sobre la ingesta de vitamina C y el riesgo de enfermedad crónica, es difícil separar los efectos de la vitamina C de los efectos de otros componentes de las frutas y verduras. Por ejemplo, se sabe que el potasio — que se encuentra en niveles altos en guineos, papas y otras frutas y verduras — es importante en la regulación de la presión arterial, y la presión arterial elevada es un factor de riesgo importante para el accidente cerebrovascular (véase el artículo sobre Potasio). Un meta-análisis del 2013 de 17 estudios de cohorte prospectivos reportó un riesgo 19% menor de accidente cerebrovascular con las ingestas dietéticas de vitamina C más altas versus las más bajas y un riesgo 38% menor con las concentraciones de vitamina C circulantes más altas versus las más bajas (59).
Un ensayo, aleatorio, doble ciego, controlado con placebo en más de 14,000 hombres mayores que participaron en el Estudio de la Salud de Médicos II (PHS II) encontró que la supementación con vitamina C (500 mg/día) por un promedio de ocho años no tuvo un efecto significativo sobre la incidencia o la mortalidad por cualquier tipo de accidente cerebrovascular (53). Otros ensayos tampoco demostraron evidencia de algún efecto de la vitamina C en el riesgo de accidente cerebrovascular. Un meta-análisis de 10 ensayos que examinaron vitaminas antioxidantes, de las cuales cinco incluyeron vitamina C, no encontró asociación entre ninguna vitamina antioxidante (vitamina C, vitamina E, o β-caroteno), administrada por sí sola o en combinación, y el riesgo de accidente cerebrovascular (60).
Cáncer
En general, los estudios de cohorte prospectivos observacionales no reportaron ninguna asociación o alguna asociación inversa modesta entre la ingesta de vitamina C y el riesgo de desarrollo de cierto tipo de cáncer (37, 61-63). A continuación, se proporcionan detalles adicionales para aquellos subtipos de cáncer con información científica sustancial obtenida de estudios de cohorte prospectivos. Los ensayos aleatorios, doble ciego, controlados con placebo que han examinado el efecto de la suplementación con vitamina C (por sí sola o en combinación con otros nutrientes antioxidantes) sobre la incidencia de cáncer o la mortalidad no han mostrado ningún efecto (64).
Cáncer de seno
Dos grandes estudios prospectivos encontraron que la ingesta dietética de vitamina C se asocia inversamente con la incidencia de cáncer de seno en ciertos subgrupos. En el Estudio de Salud de Enfermeras, las mujeres premenopáusicas con antecedentes familiares de cáncer de seno que consumieron un promedio de 205 mg/día de vitamina C de los alimentos tenían un riesgo 63% menor de cáncer de seno que aquellas que consumieron un promedio de 70 mg/día (65). En la Cohorte de Mamografía Sueca, las mujeres con sobrepeso que consumían un promedio de 110 mg/día de vitamina C tenían un riesgo 39% menor de cáncer de seno comparado con las mujeres con sobrepeso que consumían un promedio de 31 mg/día (66). Estudios de cohorte prospectivos más recientes no reportaron ninguna asociación entre la ingesta de de vitamina C dietética o suplementaria y el cáncer de seno (67-69).
Cáncer de estómago
Varios estudios observacionales han encontrado que el aumento en la ingesta de vitamina C dietética está asociado con un menor riesgo de cáncer gástrico (estómago), y los experimentos de laboratorio indican que la vitamina C inhibe la formación de compuestos cancerígenos N-nitroso en el estómago (70-72). Un estudio caso-control anidado en el Estudio Prospectivo Europeo sobre Dieta y Cáncer (EPIC) encontró un riesgo 45% menor de incidencia de cáncer gástrico en individuos en el cuartil más alto (≥51 µmol/L) versus el más bajo (<29 µmol/L) de la concentración de vitamina C en el plasma; no se observó alguna asociación entre la ingesta dietética de vitamina C y el cáncer gástrico (73).
Se sabe que la infección con la bacteria Helicobacter pylori (H. pylori) aumenta el riesgo de cáncer de estómago y se asocia con un menor contenido de vitamina C en las secreciones de estómago (74, 75). Aunque dos estudios de intervención no mostraron una reducción en la incidencia de cáncer con la suplementación con vitamina C (35), algunas investigaciones sugieren que la suplementación con vitamina C puede ser una adición útil a la terapia standard de erradicación de H. pylori para reducir el riesgo de cáncer gástrico (76). Debido a que la vitamina C puede inactivar la ureasa (una enzima que facilita la supervivencia de H. pylori y la colonización de la mucosa gástrica en pH bajo) in vitro, la vitamina C puede ser más efectiva como un agente profiláctico en las personas sin aclorhidria (77, 78).
Cáncer de colon
Al agrupar los datos de 13 estudios de cohorte prospectivos con 676,141 participantes, se determinó que la ingesta dietética de vitamina C no se asoció con el cáncer de colon, mientras que la ingesta total de vitamina C (es decir, de alimentos y suplementos) se asoció con un riesgo 19% menor de cáncer de colon (79). Cada uno de los estudios de cohorte usó cuestionarios de frecuencia de alimentos autoadministrados al inicio de estudio para evaluar la ingesta de vitamina C. Aunque el análisis se ajustó a varios factores de riesgo conocidos y de estilo de vida, los autores notaron que otros comportamientos saludables y/o la ingesta de folato pueden haber confundido la asociación.
Linfoma no Hodgkin
Un estudio prospectivo, basado en la población, el Iowa Women's Health Study, recolectó datos base en la dieta y suplementos usados en 35,159 mujeres (entre 55-69 años) y evaluó el riesgo de desarrollar linfoma no Hodgkin (NHL) después de 19 años de seguimiento (80). En general, una asociación inversa entre la ingesta de frutas y verduras y el riesgo de padecer linfoma no Hodgkin fue observado. Adicionalmente, una ingesta dietética, pero no suplementaria, y otros nutrientes antioxidantes (carotenoides, proantocianidinas, y manganeso) estuvo inversamente asociada con el riesgo de linfoma no Hodgkin. Otro estudio prospectivo, grande, multicéntrico — la Iniciativa de Salud de las Mujeres — que siguió a 154,363 mujeres posmenopáusicas durante 10 años encontró que la ingesta de vitamina C suplementaria y dietética se asoció inversamente con el linfoma difuso de células B, un subtipo de linfoma no Hodgkin (81).
Otros tipos de cáncer de lugares específicos
El Estudio de la Salud de Médicos II fue un ensayo aleatorizado, controlado con placebo, que examinó el efecto de la vitamina E (400 IU/día), la vitamina C (500 mg/día), y un suplemento multivitamínico sobre el riesgo de cáncer en 14,641 de médicos varones de mediana edad por más de 10.3 años (7.6 años de tratamiento activo más 2.8 años de seguimiento después del tratamiento) (82). La suplementación con vitamina C no tuvo ningún efecto sobre el riesgo general de cáncer ni sobre el riesgo de cáncer de próstata, vejiga o páncreas; hubo una reducción marginal de cáncer colorrectal con la vitamina C en comparación con el placebo (82).
Diabetes mellitus tipo 2
En los Institutos Nacionales de Salud (NIH) — el estudio de Dieta y Salud de la Asociación Americana de Personas Jubiladas (AARP) que incluyó 232,007 participantes, el uso de suplementos de vitamina C durante al menos siete veces a la semana se asoció con un riesgo 9% menor de desarrollar diabetes mellitus tipo 2 comparado con el uso sin suplemento (83). En una cohorte de 21,831 adultos seguidos durante 12 años en el estudio EPIC-Norfolk, se encontró que altos niveles de vitamina C en el plasma estaba fuertemente asociada con un riesgo reducido de diabetes (84). Además, varios estudios transversales reportaron asociaciones inversas entre las concentraciones de vitamina C circulante y marcadores de resistencia a la insulina o intolerancia a la glucosa, como la concentración de hemoglobina glicosilada (HbA1c) (50, 85, 86). Sin embargo, los estudios controlados aleatorios a corto plazo han encontrado efectos de la suplementación con vitamina C en la glucosa en ayunas, insulina en ayunas y concentraciones de HbA1c en individuos sanos (87). No se sabe si la vitamina C suplementaria podría mejorar los marcadores de control glicémico en sujetos con riesgo de diabetes.
Resultados adversos del embarazo
Un meta-análisis del 2015 de 29 ensayos aleatorios controlados encontró que la administración de vitamina C durante el embarazo, por sí sola o en combinación con algunos otros suplementos, no logró reducir el riesgo de muerte fetal, muerte perinatal, restricción del crecimiento intrauterino, parto prematuro, rotura prematura de membranas, y preeclampsia (88) . No obstante, la suplementación con vitamina C llevó a un riesgo 36% menor de desprendimiento de placenta y a un aumento de significativo de la edad gestacional en el nacimiento (88). Otro meta-análisis de 50 ensayos controlados aleatorios en 276,820 mujeres no encontró ningún efecto de la vitamina C, por sí sola o combinada con vitamina E o multivitaminas, cuando se suplementa durante el embarazo (comenzando antes de las 20 semanas de gestación), en los riesgos de pérdida fetal general, aborto espontáneo, y malformación congénita (89).
Fumar cigarrillos durante el embarazo causa restricción del crecimiento intrauterino y partos prematuros, entre otras complicaciones del embarazo (90, 91), y es la causa principal de enfermedad respiratoria infantil (92). Por algunas razones aún no claras, fumar se ha asociado con un menor riesgo de preeclampsia durante el embarazo (93). Un análisis secundario de un ensayo multicéntrico, aleatorio, doble ciego, controlado con placebo en casi 10,000 mujeres embarazadas no encontró reducción en el riesgo de preeclampsia con suplementos de vitamina C (1,000 mg/día) y vitamina E (400 IU/día), independientemente del estado de fumador de las mujeres durante el embarazo. Sin embargo, la suplementación con antioxidantes resultó en riesgos reducidos de desprendimiento de la placenta y el parto prematuro en las mujeres que fumaron durante el embarazo pero no en las no-fumadoras (94). Otro ensayo piloto multicéntrico encontró una mejor función pulmonar durante la primera semana de vida y un menor riesgo de sibilancia durante un año de edad en bebés cuyas madres fumadoras fueron asignadas aleatoriamente para recibir vitamina C (500 mg/día) en vez de un placebo durante el embarazo (95). El estudio de La Vitamina C para Reducir los Efectos de Fumar durante el Embarazo sobre la Función Pulmonar de los Infantes [VCSIP] es un ensayo en curso diseñado para confirmar estas observaciones preliminares utilizando mediciones más precisas de la función pulmonar en una muestra más grande de mujeres asignadas al azar para recibir suplementos de vitamina C o placebo (96).
Enfermedad de Alzheimer
En los EE. UU., la enfermedad de Alzheimer (EA) es la forma más común de demencia, que afecta a 5.5 millones de personas de 65 años y más (97). Estrés oxidativo, neuroinflamación, deposición de placa β-amiloide, marañas formadoras de proteína Tau y muerte de células neuronales en el cerebro de los sujetos afectados por la EA se han asociado con el deterioro cognitivo y pérdida de memoria. Se encontró que las concentraciones más bajas de vitamina C en el fluido cerebroespinal y la matriz extracelular cerebral de un modelo de ratón de EA aumentan el estrés oxidativo y aceleran la deposición de amiloide y la progresión de la enfermedad (98). En otro modelo de ratón de EA que carecía de la capacidad de sintetizar vitamina C, la suplementación con una dosis alta versus baja de vitamina C redujo la deposición de amiloide en la corteza y el hipocampo y limitó los impedimentos de la barrera hematoencefálica y la disfunción mitocondrial (99).
La mayoría de los grandes estudios basados en la población que examinan la relación entre la ingesta de vitamina C o su suplementación con la incidencia de EA han reportado resultados nulos (100). En contraste, los estudios observacionales reportaron concentraciones de vitamina C en el plasma menores en pacientes con EA en comparación con sujetos cognitivamente sanos (101) y se encontró mejor función cognitiva o menor riesgo de deterioro cognitivo con una mayor cantidad de vitamina C en plasma (100).
Pocos estudios han medido la concentración de vitamina C en el fluido cerebroespinal, que refleja mejor el estatus de la vitamina C en el cerebro. La vitamina C se concentra en el cerebro a través de una combinación de transporte activo al tejido cerebral y la retención a través de la barrera hematoencefálica (100). Aunque la vitamina C del fluido cerebroespinal se mantiene en concentraciones muchas veces más altas que la vitamina C en plasma, la función precisa de la vitamina C en la función cognitiva y la etiología de la EA aún no se comprende completamente (102). En un pequeño estudio longitudinal de biomarcadores en 32 individuos con EA probable, una mayor proporción de vitamina C en el fluido cerebroespinal a plasma en la base se asoció con una tasa más lenta de deterioro cognitivo al año de seguimiento (103). La integridad de la barrera hematoencefálica dañada puede afectar la capacidad del cerebro para retener la vitamina C y por lo tanto mantener una alta proporción de vitamina C entre el fluido cerebroespinal y el plasma. La importancia de la proporción de vitamina C en el fluido cerebroespinal a plasma en la progresión de la EA requiere más estudio.
El efecto de la suplementación con vitamina C, en combinación con otros antioxidantes, en los biomarcadores de fluido cerebroespinal y la función cognitiva se ha examinado sólo en unos pocos ensayos con pacientes con EA. En un pequeño (n=23), ensayo abierto, la suplementación combinada con vitamina C (1,000 mg/día) y vitamina E (400 UI/día) a pacientes con EA que tomaron un inhibidor de colinesterasa aumentó significativamente los niveles de antioxidantes y redujo la oxidación de lipoproteínas en el fluido cerebroespinal después de un año, pero no tuvo efecto en el curso clínico de EA comparado con los controles (104). Se obtuvo un resultado similar en un ensayo controlado aleatorio, doble ciego, en el que se combinó la suplementación con vitamina C (500 mg/día), vitamina E (800 UI/día), y el ácido α-lipoico (900 mg/día) durante 16 semanas redujo la oxidación de lipoproteínas en el fluido cerebroespinal, pero no obtuvo beneficios clínicos en individuos con EA leve a moderada (n=78) (105). En este último ensayo, se observó un mayor declive en puntuaciones del Mini Examen del Estado Mental (MEEM) fe observado en el grupo suplementado, sin embargo, la importancia de esta observación permanece inconclusa. Un tercer ensayo controlado con placebo en adultos mayores con deterioro cognitivo leve (edades, 60-75 años) encontró que la suplementación de vitamina C por un año (400 mg/día) y vitamina E (300 mg/día) mejoró la capacidad sanguínea antioxidante, pero sin efecto en los puntajes MEEM (106).
En este momento, parece prudente evitar la deficiencia o insuficiencia de vitamina C, en lugar de la suplementación en individuos repletos, para promover un envejecimiento cerebral saludable (101).
Cataratas
El cristalino del ojo enfoca la luz, produciendo una clara detallada imagen en la retina, una capa de tejido en la pared posterior del globo ocular. Cambios al cristalina relacionados con la edad (engrosamiento, pérdida de flexibilidad) y daño oxidativo contribuyen a la formación de cataratas, p. ej., nubosidad u opacidad en el cristalino que interfiere con un claro enfoque de las imágenes en la retina.
En los seres humanos, la concentración de vitamina es aproximadamente 15 a 20 veces mayor en el humor acuoso — fluido que llena las cámaras anterior y posterior del ojo) que en el plasma, lo cual sugiere que la vitamina C puede estar desempeñando un papel importante en el ojo (107). Disminución de las concentraciones de vitamina C en el cristalino del ojo se han asociado con una mayor severidad de las cataratas (108). Un meta-análisis de estudios observacionales encontró un riesgo reducido de catarata relacionado con la edad con mayores ingestas de vitamina C en estudios caso-control y con mayores concentraciones de vitamina C circulante en estudios transversales. Sin embargo, no se encontraron asociaciones de este tipo en los análisis agrupados de los estudios de cohorte prospectivos (109). De hecho, dos estudios de cohorte prospectivos en hombres suecos (110) y mujeres (111) reportaron que una dosis alta de suplementos con un solo nutriente de vitamina C se asociaron con un mayor riesgo de cataratas, especialmente en aquellos en terapia con corticosteroides.
Una revisión de 2012 de nueve ensayos controlados aleatorios no encontró un efecto sustancial por parte del β-caroteno, la vitamina C, y la vitamina E, administrados individualmente o en combinación durante 2.1 a 12 años, en el riesgo de cataratas o cirugía de cataratas (112). Aunque los ensayos actualmente no respaldan el uso de suplementos con vitamina C de dosis altas en la prevención de cataratas, se observa una asociación inversa consistente entre la ingesta diaria alta de frutas y/o verduras (>5 porciones/día) y el riesgo de catarata (113).
Gota
La gota, una condición que aflige a más del 4% de adultos estadounidenses (114), está caracterizada por concentraciones anormalmente altas de ácido úrico (urato) en la sangre (115). Cristales de urato pueden formarse en las articulaciones, resultando en inflamación y dolor, como también en los riñones y el tracto urinario, resultando en cálculos renales. La tendencia de exhibir elevados niveles de ácido úrico en la sangre y la enfermedad de la gota es a menudo heredada; sin embargo, una modificación en la dieta o el estilo de vida pueden ser provechosos en ambos tratamiento y prevención de la gota (116). En un estudio observacional que incluyó 1,387 hombres, altas ingestas de vitamina C fueron asociadas con concentraciones séricas más bajas de ácido úrico (117). En un estudio transversal realizado en 4,576 afroamericanos, las probabilidades de tener hiperuricemia se asociaron con ingestas dietéticas altas en fructosa, bajas en vitamina C, o con altas proporciones de fructosa a vitamina C (118). Un estudio prospectivo que siguió a una cohorte de 46,994 hombres durante 20 años encontró que la ingesta diaria total de vitamina C se asoció inversamente con la incidencia de gota, mientras que mayores ingestas se asociaron con mayores reducciones de riesgo (119). Los resultados de este estudio también indicaron que la vitamina C suplementaria puede ser útil en la prevención de la gota (119).
Un meta-análisis del 2011 de 13 ensayos controlados aleatorios en individuos sanos con altas concentraciones séricas de ácido úrico reveló que la suplementación con vitamina C (una dosis media de 500 mg/día durante una duración media de 30 días) redujo moderadamente las concentraciones séricas de ácido úrico en 0.35 mg/dL comparado con placebo (120). Esta reducción se encuentra dentro del rango de variabilidad del ensayo y es poco probable que sea clínicamente significativa (121). Un ensayo abierto, de ocho semanas, controlado, aleatorizó a 40 sujetos con gota para recibir ya sea alopurinol (estándar de cuidado), vitamina C, o ambos tratamientos (122). El efecto de la vitamina C, solo o con alopurinol, disminuyendo el ácido úrico en suero fue moderado y mucho menor que el alopurinol solo. El ensayo no examinó el efecto de la vitamina C en otros resultados asociados con la gota (122).
A pesar de que los estudios observacionales sugirieron que la vitamina C suplementaria puede ser útil para prevenir la gota incidente y recurrente, los estudios de intervención realizados hasta el momento no lo han demostrado. Además, actualmente hay poca evidencia para apoyar el papel de la vitamina C en el tratamiento de los pacientes con gota (123).
Mortalidad
Dos grandes estudio de cohorte prospectivos evaluaron la relación entre la ingesta de vitamina C dietética y suplementaria y la mortalidad. En el Vitamins and Lifestyle Study, 55,543 hombres y mujeres (entre 50-76 años) fueron cuestionados como línea base sobre el uso de suplementos dietarios durante los 10 años previos (124). Después de cinco años de seguimiento, el uso de la vitamina C suplementaria se asoció con una ligera disminución del riesgo de mortalidad total, aunque ninguna asociación fue encontrada con enfermedad cardiovascular — o una mortalidad específica de cáncer. En el segundo estudio de cohorte prospectiva, el Diet, Cancer, and Health Study, 55,543 adultos daneses (entre 50-64 años) fueron cuestionados como línea de base acerca de su estilo de vida, dieta, y el uso de suplementos durante los 12 meses previos (125). No se encontró ninguna asociación entre la ingesta de vitamina C dietética o suplementaria y la mortalidad después de aproximadamente 14 años de seguimiento. En contraste, un meta-análisis del 2014 de 10 estudios de cohorte prospectivos en 17,696 mujeres con cáncer de seno encontró un menor riesgo de mortalidad total y específica del cáncer de seno con una mayor ingesta de vitamina C suplementaria y dietética (126). Un meta-análisis del 2012 de de 29 ensayos no encontró ningún efecto de la vitamina C oral, administrada por sí sola o en combinación con otros antioxidantes, en la mortalidad por todas las causas (127).
En paralelo a estos estudios de evaluación dietética, se observó una fuerte asociación inversa entre la vitamina C en el plasma y la mortalidad por todas las causas, la enfermedad cardiovascular y la enfermedad cardíaca isquémica (y el cáncer en hombres solamente) en el estudio multicéntrico prospectivo de cohorte EPIC-Norfolk (128). Después de aproximadamente cuatro años de seguimiento en 19,496 hombres y mujeres (edades 45-79 años), se observó una relación dosis-respuesta tal que cada aumento de 20 µmol/L en la vitamina C en el plasma se asoció con una reducción de riesgo estimada del 20% en mortalidad por todas las causas. De manera similar, las concentraciones más altas de vitamina C en suero se asociaron con menores riesgos de mortalidad por cáncer y por todas las causas en 16,008 adultos de la Encuesta de Evaluación Nacional de Salud y Nutrición (NHANES) III (1994-1998) (129).
Tratamiento de Enfermedad
Enfermedad cardiovascular
Complicaciones de procedimientos cardíacos y cirugías
Lesión miocárdica periprocedimental: La angioplastia coronaria (también llamada angioplastia coronaria transluminal percutánea) es un procedimiento no quirúrgico para el tratamiento de la cardiopatía coronaria obstructiva (CHD, en inglés), incluyendo la angina de pecho inestable, el infarto al miocardio agudo y la CHD de múltiples vasos. La angioplastia consiste en insertar temporalmente e inflar un pequeño globo en la arteria obstruida para ayudar a restablecer el flujo de sangre al corazón. La lesión miocárdica periprocedimental que ocurre en hasta un tercio de los pacientes que se someten a una angioplastia sin complicaciones aumenta el riesgo de morbilidad y mortalidad en seguimiento.
Un ensayo aleatorizado, controlado con placebo, ha examinado el efecto de la vitamina C intravenosa administrada a pacientes con angina estable que se someten a angioplastia coronaria electiva (130). La administración de una infusión de vitamina C de 1 gramo (g) una hora antes de la angioplastia redujo las concentraciones de marcadores de estrés oxidativo y mejoró la perfusión circulatoria en comparación con el placebo (130). Otro ensayo aleatorizó a 532 pacientes para recibir una infusión de 3g de vitamina C o un placebo (solución salina) dentro de las seis horas previas a angioplastia coronaria (131). El tratamiento con vitamina C redujo sustancialmente la incidencia de lesión miocárdica periprocedimental, según se evaluó mediante una reducción en las concentraciones de dos marcadores de lesión miocárdica, a saber, creatina quinasa y troponina-I (131). Un ensayo controlado aleatorio evaluó el efecto de la administración de vitamina C y vitamina E sobre el daño por reperfusión en pacientes que sufrieron un infarto al miocardio agudo y se sometieron a una angioplastia coronaria (ver más abajo) (132).
Lesión por reperfusión miocárdica: La lesión por reperfusión se refiere al daño tisular que se produce en el momento de la restauración del flujo sanguíneo (reperfusión) después de una isquemia transitoria. El músculo cardíaco puede volverse privado de oxígeno (isquémico) como resultado de un infarto al miocardio o con pinzamiento aórtico durante la cirugía de injerto de derivación arterial coronaria (IDAC). El aumento de la generación de especies reactivas de oxígeno (EOR) cuando se restaura el suministro de oxígeno del músculo cardíaco podría ser un contribuyente importante al daño del miocardio que ocurre en la reperfusión (133). La lesión de reperfusión miocárdica conlleva complicaciones, tales como arritmias por reperfusión (véase Fibrilación auricular) y miocardio aturdido.
La vitamina C se agota durante y después de la cirugía cardíaca (134) y esto puede deberse a la extinción de las EOR, a la regeneración de otros antioxidantes, y/o una síntesis masiva de catecolaminas (dopamina, epinefrina, norepinefrina) (135). Dos ensayos aleatorios controlados realizados en la década de los 90 informaron una disminución en el estrés oxidativo inducido por la reperfusión y la lesión miocárdica con la administración de vitamina C intravenosa (136) u oral (137) antes de la cirugía IDAC (revisado en 135). Se ha diseñado un ensayo más reciente aleatorizado, doble ciego, controlado con placebo para examinar el efecto de la administración de vitamina C y vitamina E sobre el daño por isquemia-reperfusión en 99 pacientes con infarto al miocardio agudo sometidos a angioplastia coronaria (132). La infusión de vitamina C (ascorbato de sodio: 3.20 mmol/min durante 1 hora, luego 0.96 mmol/min durante 2 horas) antes de la reperfusión, seguido de una suplementación oral con vitamina C (1 g/día) y vitamina E (400 IU/día) durante 84 días impidió efectivamente una reducción en la capacidad antioxidante en reperfusión y durante las siguientes seis a ocho horas. el protocolo también limitó la disfunción microvascular (es decir, mejoró la perfusión de la microcirculación) y mejoró la fracción de eyección del ventrículo izquierdo al alta (en el día 84) (138, 139). Sin embargo, no se observaron diferencias en el tamaño del infarto entre el tratamiento con vitaminas antioxidantes y el placebo (138).
Fibrilación auricular: La fibrilación auricular es el tipo más común de arritmia cardíaca. También es una complicación común de la cirugía post-cardíaca, que conlleva un mayor riesgo de morbilidad cardiovascular (p. ej., insuficiencia cardíaca, accidente cerebrovascular) y mortalidad. Tres meta-análisis de estudios de cohorte prospectivos y ensayos aleatorios controlados han reportado una reducción general del riesgo de fibrilación auricular postoperatoria después de la administración de vitamina C principalmente por vía oral (140-142). En la mayoría de los ensayos, los participantes recibieron 2 g de vitamina C antes de someterse a una cirugía de reemplazo de válvula o ICAD y 1 a 2 g/día durante cinco días después de la cirugía. Aunque sólo una minoría de los ensayos administraron vitamina C por vía intravenosa, esta vía de administración pareció ser más efectiva para reducir el riesgo de fibrilación auricular — probablemente debido al alcance de concentraciones plasmáticas más altas (140). Es importante señalar que un análisis de subgrupos en uno de los meta-análisis mostró una reducción de la fibrilación auricular postoperatoria con vitamina C en ensayos no basados en los EE. UU. (10 ensayos) pero ningún efecto de la vitamina C en ensayos basados en los EE. UU. (5 ensayos) (140).
Lesión cerebral por isquemia-reperfusión
Un pequeño ensayo controlado aleatorio realizado en 60 pacientes con accidente cerebrovascular isquémico mostró que la administración intravenosa de vitamina C (500 mg/día por 10 días, iniciado el día 1 después del accidente cerebrovascular) no tuvo efecto en los marcadores séricos de estrés oxidativo o resultados neurológicos en comparación con el placebo (143).
Complicaciones vasculares de la diabetes mellitus
La enfermedad cardiovascular (ECV) es la principal causa de muerte en personas con diabetes mellitus. El papel del aumento del estrés oxidativo en la ocurrencia de complicaciones vasculares en sujetos con diabetes ha llevado a la hipótesis de que una mayor ingesta de nutrientes antioxidantes podría ayudar a disminuir el riesgo de ECV en sujetos diabéticos (144). Un meta-análisis de 2018 de ensayos controlados aleatorios investigando el efecto de los suplementos de vitaminas antioxidantes en pacientes con diabetes tipo 2 encontró que la mayor parte de las mejoras en los marcadores de estrés oxidativo y el control de la glucosa en la sangre podrían atribuirse a la vitamina E (145). Otro meta-análisis de los ensayos no encontró efectos de las vitaminas E y C, solas o en combinación, sobre las mediciones de la función de las células β y la resistencia a la insulina (146). Sin embargo, la mayoría de los estudios fueron pequeños y de corta duración y, por lo tanto, no evaluaron las consecuencias del uso a largo plazo de vitaminas antioxidantes en el riesgo de complicaciones vasculares en pacientes diabéticos. Un ensayo aleatorio controlado con placebo de 12 meses en 456 participantes con diabetes tipo 2 tratados con metformina examinó el efecto de la vitamina C (500 mg/día) o del ácido acetilsalicílico (aspirina; 100 mg/día) sobre los factores de riesgo de complicaciones relacionadas a las diabetes como las ECV (147). Tanto la vitamina C como la aspirina redujeron la glucosa en la sangre en ayunas y las concentraciones de HbA1c y mejoraron el perfil de lípidos en la sangre en pacientes tratados con metformina. En comparación con el placebo, se encontró que ambos tratamientos tenían más probabilidades de limitar los factores de riesgo que contribuyen a las complicaciones relacionadas con la diabetes, así como a reducir el riesgo de futuros eventos cardiovasculares durante un período de 10 años (estimado utilizando la puntuación de riesgo de Framingham) (147).
Es de destacar que es posible que las diferencias genéticas entre los pacientes diabéticos influyan en el efecto de la suplementación de la vitamina C en el riesgo cardiovascular. En particular, un alelo específico del gen de la haptoglobina (Hp), a saber, Hp2, parece estar asociado con un mayor riesgo de complicaciones vasculares diabéticas. Los portadores de dos copias del alelo Hp2 (Hp2-2) expresan una proteína Hp que tiene una menor eficacia para unir y eliminar la hemoglobina pro-oxidante libre (Hb) del plasma, en comparación con las proteínas Hp codificadas por los genotipos Hp1-1 y Hp1-2. Cuando se volvieron a analizar los resultados del ensayo Women's Antioxidant Vitamin Estrogen (WAVE) basado en el genotipo Hp, la terapia antioxidante (1,000 mg/día de vitamina C + 800 UI/día de vitamina E) se asoció con una mejora de la aterosclerosis coronaria en mujeres diabéticas con el genotipo Hp1-1 pero con un empeoramiento de la aterosclerosis en aquellas portadoras del genotipo Hp2-2 (148). Los resultados de otro estudio realizado por los mismos investigadores sugirieron que la vitamina C no pudo prevenir la oxidación de colesterol de lipoproteínas de alta densidad (HDL) por complejos in vitro de Hb-Hp2-2 glicados ni la restauración de la función dañada de HDL en ratones diabéticos portadores del genotipo Hp2-2 (149).
Sepsis
La sepsis y el shock séptico — definidos como presión arterial baja inducida por sepsis persistente — están asociadas con tasas de mortalidad elevadas en pacientes en estado crítico (150, 151). Debido a que las respuestas inflamatorias sistémicas implican un estrés oxidativo excesivo, se ha sugerido que el suministro de nutrientes antioxidantes como la vitamina C puede mejorar el resultado de pacientes en estado crítico en unidades de cuidado intensivo. Además, la hipovitaminosis C es común en pacientes en estado crítico, especialmente en aquellos con shock séptico, y persiste a pesar de la terapia nutricional enteral/parenteral la cual proporciona las cantidades recomendadas de vitamina C (152). Es probable que los requerimientos de vitamina C aumenten en esta población debido a la respuesta hipermetabólica impulsada por la reacción inflamatoria sistémica (152, 153). Se encontró que la administración intravenosa de 50 mg o 200 mg de vitamina C por kg por día durante 96 horas a pacientes con sepsis ingresados en la unidad de cuidado intensivo corrige la deficiencia de vitamina C. La vitamina C también evitó el aumento de las puntuaciones de la Evaluación de Fallo Orgánico Secuencial (SOFA) y del Sistema de Clasificación de Severidad de Enfermedad (APACHE) II — que se utiliza para evaluar la gravedad de la enfermedad y el riesgo de mortalidad — observado en pacientes tratados con placebo (154). La infusión de vitamina C también disminuyó la concentración de marcadores de inflamación y lesión endotelial en pacientes en comparación con placebo (154). En otro ensayo controlado, aleatorio, doble ciego, en 28 pacientes en estado crítico con shock séptico, la infusión de 25 mg de vitamina C por kg cada seis horas por 72 horas limitó significativamente el requerimiento del vasopresor norepinefrina — disminuyendo tanto la dosis como la duración del tratamiento — y mejoró dramáticamente la tasa de supervivencia de 28 días (155). Se han reportado resultados similares en pacientes sépticos que recibieron vitamina C por vía intravenosa (1.5 g/6 h), hidrocortisona (50 mg/6 h), y tiamina (200 mg/12 h) hasta el alta hospitalaria. En comparación con el estándar de atención, este cóctel de intervención redujo en más de la mitad la duración media del uso de vasopresores (18.3 h versus 54.9 h) y redujo las probabilidades de mortalidad en casi un 90% (156). Aunque la administración intravenosa de vitamina C parece ser segura y adecuadamente tolerada, existe un riesgo no despreciable de nefropatía por oxalato (una causa poco frecuente de insuficiencia renal) en estos pacientes en estado críticos (157).
Cáncer
Ruta de administración
En estudios realizados en los años 70 y 80 por Linus Pauling, Ewan Cameron y sus colegas, sugirieron que grandes dosis de vitamina C (10 g/día inyectados por vía intravenosa durante 10 días seguidos de al menos 10 g/día por vía oral indefinidamente) fueron útiles para aumentar el tiempo de supervivencia y la mejora de la calidad de vida de los pacientes con cáncer terminal (158). La controversia sobre la eficacia de la vitamina C en el tratamiento del cáncer se produjo, lo que llevó al reconocimiento de que la ruta de administración de vitamina C es crítica (22, 159). En comparación con la vitamina C administrada por vía oral, la vitamina C intravenosa puede resultar en concentraciones de vitamina C en el plasma de 30 a 70 veces más altas (25). Las concentraciones plasmáticas más altas logradas a través de la administración intravenosa de vitamina C son comparables a las que son tóxicas para las células cancerosas en cultivo. El mecanismo anticancerígeno de la acción intravenosa de la vitamina C está bajo investigación. Este puede implicar la producción de altos niveles de peróxido hidrógeno, selectivamente tóxico para las células cancerosas (22, 160-162), o la desactivación del factor inducible por hipoxia, un factor de transcripción de supervivencia que protege las células cancerosas de varias formas de estrés (159, 163, 164). Es probable que la vitamina C también desempeñe un papel en el mantenimiento de la integridad del genoma y en la protección contra la transformación celular a través de la regulación del ADN y de las enzimas de desmetilación de histonas (véase Función) (165).
Seguridad
La evidencia actual de ensayos clínicos controlados indica que la vitamina C intravenosa es generalmente segura y bien tolerada en pacientes con cáncer. Es de destacar que debido a que la administración intravenosa de 80 g de vitamina C precipitó la anemia hemolítica en dos sujetos con deficiencia de glucosa-6-fosfato deshidrogenasa, los pacientes que van a recibir una infusión de vitamina C en dosis altas se examinan sistemáticamente por este trastorno genético (166). Cuatro ensayos clínicos de fase I en pacientes con cáncer avanzado encontraron que la administración intravenosa de vitamina C en dosis de hasta 1.5 g/kg de peso corporal (equivalente a aproximadamente 100 g/día para un peso promedio [70 kg] por persona) y 70 a 80 g/m2 fue bien tolerado y seguro en pacientes pre-examinados (167-170). Unos pocos estudios observacionales en pacientes con cáncer sometidos a quimioterapia y/o radioterapia informaron que el tratamiento complementario con vitamina C intravenosa se asoció con una reducción de los efectos secundarios asociados con el tratamiento y una mejor calidad de vida (171). Un estudio de fase I en nueve pacientes con cáncer pancreático metastático demostraron que se podían alcanzar concentraciones milimolares de vitamina C en plasma de forma segura cuando se administraba junto con los medicamentos para la quimioterapia contra el cáncer, la gemcitabina y el erlotinib (168).
Sensibilidad a la vitamina C
Los ensayos retrospectivos de formación de colonias in vitro revelaron que las células leucémicas de los pacientes mostraron una sensibilidad variable al tratamiento con vitamina C: las células leucémicas de siete de los nueve pacientes que experimentaron un beneficio clínico significativo fueron sensibles a la vitamina C in vitro (es decir, "respondedores"); las células leucémicas de los seis pacientes restantes no eran sensibles a la vitamina C (es decir, "no-respondedores"). Por lo tanto, los ensayos de sensibilidad a la vitamina C in vitro pueden proporcionar un valor predictivo para la respuesta clínica al tratamiento con vitamina C intravenosa. Los mecanismos que subyacen a la sensibilidad diferencial a la vitamina C están bajo investigación. Los experimentos in vitro realizados con 11 diferentes líneas de células cancerosas demostraron que la sensibilidad a la vitamina C se correlacionó con la expresión de la catalasa, una enzima involucrada en la descomposición del peróxido de hidrógeno (172). Aproximadamente la mitad de las líneas celulares analizadas eran resistentes a la citotoxicidad de la vitamina C, una respuesta asociada con altos niveles de actividad de catalasa.
La sensibilidad a la vitamina C también puede determinarse por la expresión del transportador-2 de la vitamina C dependiente del sodio (SVCT-2), que transporta la vitamina C a las células (173). Los niveles más altos de SVCT-2 se asociaron con una mayor sensibilidad a la vitamina C en nueve niveles diferentes de líneas de células cancerosas de cáncer de seno, pero se expresó débilmente en tejidos normales. Finalmente, las mutaciones en los genes que codifican para las desmetilasas TET dependientes de la vitamina C, mutaciones que son comunes en las células cancerosas, también pueden contribuir a la resistencia al tratamiento con vitamina C (165).
Eficacia
La evidencia actual de la eficacia de la vitamina C intravenosa en pacientes con cáncer se limita a los estudios observacionales, las intervenciones no controladas, y los informes de casos (174, 175). Se necesitan ensayos clínicos de fase II más grandes y de mayor duración que evalúen la eficacia de la vitamina C intravenosa en la progresión de enfermedad y supervivencia en general (176).
Resfriado común
El trabajo de Linus Pauling estimuló el interés público en el uso de dosis superiores a 1 g/día de vitamina C para prevenir el resfriado común (177). En los últimos 40 años, numerosos ensayos controlados con placebo han examinado el efecto de la suplementación con vitamina C en la prevención y tratamiento de resfriados. Un meta-análisis de 2013 de 53 ensayos controlados con placebo evaluó el efecto de la suplementación con vitamina C en la incidencia, duración, o gravedad del resfriado común cuando se toma como un suplemento diario continuo (43 ensayos) o como terapia para el inicio de los síntomas del resfriado (10 ensayos) (178). Con respecto a la incidencia de resfriados, se observó una diferencia entre dos grupos de participantes. La suplementación regular con vitamina C (0.25 a 2 g/día) no redujo la incidencia de resfriados en la población general (23 ensayos); sin embargo, en pacientes con estrés físico intenso (p. ej., corredores de maratón, esquiadores, o soldados en condiciones subárticas), la suplementación con vitamina C redujo a la mitad la incidencia de resfriados (5 ensayos). También se observó un beneficio de la suplementación regular con vitamina C en la duración de los resfriados, con un mayor beneficio en niños que en adultos: El efecto combinado de la suplementación con vitamina C fue una reducción del 14% en la duración del resfriado en niños y una reducción del 8% en adultos. Finalmente, no se observó ningún efecto significativo de la suplementación con vitamina C (1-8 g/día) en los ensayos terapéuticos en los que se administró vitamina C después de que ocurrieron los síntomas del resfriado.
Además, una revisión sistemática de 2013 realizada por los mismos investigadores identificó sólo dos pequeños ensayos aleatorios, doble ciego, controlados con placebo que examinaron el efecto de la vitamina C en la incidencia de asma inducida por infección respiratoria (179). Un ensayo encontró que la suplementación con vitamina C (1 g/día) durante 14 semanas redujo el riesgo de ataques de asma precipitados por infección respiratoria. El otro ensayo asignó al azar a sujetos diagnosticados con asma relacionada con la infección para recibir 5 g/día de vitamina C o un placebo durante una semana; se encontró que una proporción menor de participantes presentaba hipersensibilidad bronquial a la histamina — que caracteriza el asma crónica — en el grupo de vitamina C en comparación con el grupo control (revisado en 179). Estas observaciones deben confirmarse en ensayos más grandes y bien diseñados.
Estas observaciones deben confirmarse en ensayos más grandes y bien diseñados.
Asma
Una revisión sistemática de 2013 identificó 11 estudios controlados aleatorios que evaluaron el efecto de la vitamina C en el asma (ocho ensayos) o la broncoconstricción inducida por el ejercicio (tres ensayos) (180). La broncoconstricción inducida por el ejercicio es un estrechamiento transitorio de las vías respiratorias que ocurre después del ejercicio y es indicada por una disminución de ≥10% en Volumen Espiratorio Forzado en 1 segundo (VEF1, o en sus siglas en inglés FEV1). En los tres ensayos que incluyeron un total de 40 participantes con broncoconstricción inducida por el ejercicio, la administración de vitamina C antes del ejercicio (una dosis de 0.5 g en dos días posteriores en un ensayo, una dosis única de 2 g en el segundo ensayo y 1.5 g diariamente durante dos semanas en el tercer ensayo) redujo significativamente la disminución inducida por ejercicio en FEV1. Entre los cinco de los ocho ensayos en sujetos asmáticos que informaron sobre los resultados del FEV1, ninguno encontró una diferencia entre la suplementación con vitamina C y el placebo (180).
Toxicidad del plomo
A pesar de que el uso de pintura con plomo y gasolina con plomo se ha suspendido en los EE. UU., la toxicidad del plomo sigue siendo un problema de salud importante, especialmente en los niños que viven en áreas urbanas. Se ha observado un crecimiento y desarrollo anormales en los bebés de mujeres expuestas al plomo durante el embarazo, mientras que los niños que están expuestos crónicamente al plomo tienen más probabilidades de desarrollar problemas de aprendizaje, problemas de conducta, y tener un CI bajo. En los adultos, la toxicidad del plomo puede causar daño renal, presión arterial alta y anemia.
Varios estudios transversales han informado una asociación inversa entre el estatus de la vitamina C y la concentración de plomo en la sangre. De hecho, en un estudio de 747 hombres mayores, la concentración de plomo en la sangre fue significativamente mayor en aquellos que informaron ingestas totales de vitamina C dietética con un promedio de menos de 109 mg/día en comparación con aquellos con mayores ingestas de vitamina C (181). Un estudio mucho más grande de 19,578 personas, incluyendo 4,214 niños de 6 a 16 años de edad, encontró que concentraciones más altas de vitamina C en suero se asocian con concentraciones de plomo en la sangre significativamente más bajas (182). Una encuesta nacional estadounidense de más de 10,000 adultos encontró que las concentraciones de plomo en la sangre estaban inversamente relacionadas a las concentraciones de vitamina C en suero (183).
Fumar cigarrillos o la exposición de segunda mano al humo del cigarrillo contribuye a aumentar la concentración de plomo en la sangre y a un estado de exposición crónica de bajo nivel al plomo. Un ensayo de intervención en 75 fumadores varones adultos encontró que la suplementación con 1,000 mg/día de vitamina C dio como resultado una concentración de plomo en la sangre significativamente más baja durante un período de tratamiento de cuatro semanas comparación con placebo (184). Una dosis más baja de 200 mg/día no afectó significativamente la concentración de plomo en la sangre, aunque las concentraciones de vitamina C en suero no fueron diferentes de las del grupo que tomó 1,000 mg/día.
El(los) mecanismo(s) por el(los) cual(es) la vitamina C reduce la concentración de plomo en la sangre no se conoce(n), sin embargo, se ha propuesto que la vitamina C podría inhibir la absorción intestinal (184) o mejorar la excreción urinaria de plomo (185).
Fuentes
A diferencia de las plantas y la mayoría de los animales, los humanos han perdido la capacidad de sintetizar la vitamina C de forma endógena y, por lo tanto, tienen un requisito dietético esencial para esta vitamina (véase La Ingesta Diaria Recomendada). Los resultados de 7,277 participantes en la Encuesta Nacional de Salud y Examen Nutricional de los EE. UU. (NHANES) del 2003-2004 indicaron que aproximadamente el 7.1% de los individuos de edades de ≥6 años eran deficientes en vitamina C — basado en concentraciones de vitamina C en suero <11.4 µmol/L (36). El estudio nacional identificó que los fumadores y aquellos con un estatus socioeconómico más bajo tienen un mayor riesgo de deficiencia de vitamina C (36).
Fuentes alimenticias
Como se muestra en la Tabla 3, diferentes frutas y verduras varían en su contenido de vitamina C, pero cinco porciones (equivalentes a 2½ de taza) de una variedad de frutas y verduras deben tener un promedio de entre 150 y 200 mg de vitamina C, especialmente si se consumen frutas ricas en vitamina C. Si desea verificar el contenido de vitamina C, consulte la base de datos de composición de alimentos del USDA.
| Alimento | Porción | Vitamina C (mg) |
|---|---|---|
| Kiwi, Zespri SunGold | 1 fruta (81 g) | 131 |
| Zumo de pomelo, rosado, crudo | ¾ taza (6 onzas) | 94 |
| Jugo de naranja, crudo | ¾ taza (6 onzas) | 93 |
| Fresas | 1 taza, enteras | 85 |
| Zumo de pomelo, blanco, crudo | ¾ taza (6 onzas) | 70 |
| Kiwi | 1 fruta (74 g) | 69 |
| Naranja | 1 mediana | 65 |
| Pimiento rojo dulce, crudo | ½ taza, picada | 59 |
| Brócoli, cocidos | ½ taza | 51 |
| Pomelo, crudo | ½ mediana | 44 |
| Coles de bruselas, cocidas | ½ taza | 37 |
| Papa, blanca, pulpa y piel | 1 mediana, horneada | 22 |
| Tomate, rojo, maduro, crudo | 1 mediano | 17 |
| Guineo, crudo | 1 mediano | 10 |
| Manzana, cruda | 1 mediana | 8 |
| Espinaca, cruda | 1 taza | 8 |
Suplementos
La vitamina C (ácido ascórbico-L) está disponible en muchas formas, pero hay poca evidencia científica de que una forma sea mejor absorbida o más efectiva que otra. La mayoría de las investigaciones clínicas y experimentales utilizan ácido ascórbico o su sal de sodio, llamado ascorbato de sodio. El ácido ascórbico-L natural y sintético son químicamente idénticos y no se conocen diferencias con respecto a las actividades biológicas o la biodisponibilidad (186).
Ascorbatos minerales
Las sales minerales de la vitamina C se consideran menos ácidas que la vitamina C y, por lo tanto, se consideran "tamponadas." Algunas personas las encuentran menos irritantes para el tracto gastrointestinal que el ácido ascórbico. El ascorbato de sodio y el ascorbato de calcio son las formas más comunes, aunque hay otros ascorbatos minerales disponibles. El ascorbato de sodio proporciona 111 mg de sodio (889 mg de ácido ascórbico) por 1,000 mg de ascorbato de sodio, y el ascorbato de calcio generalmente proporciona de 90 a 110 mg de calcio (890-910 mg de ácido ascórbico) por 1,000 mg de ascorbato de calcio.
Vitamina C con flavonoides
Los flavonoides son una clase de pigmentos vegetales solubles en agua que se encuentran a menudo en las frutas y verduras ricas en vitamina C, especialmente las frutas cítricas y las bayas . Hay poca evidencia de que los flavonoides en la mayoría de las preparaciones comerciales aumenten la biodisponibilidad o la eficacia de la vitamina C (187). Algunos, pero no todos, estudios en modelos animales como las cobayas deficientes en vitamina C o ratas genéticamente escorbúticas encontraron un aumento en la ingesta de vitamina C en circulación periférica y órganos específicos en presencia de flavonoides. Sin embargo, los estudios realizados en seres humanos no encontraron diferencias en la biodisponibilidad de la vitamina C de la fruta entera rica en flavonoides o el jugo de fruta y la vitamina C sintética (revisado en 186).
Vitamina C y metabolitos
Un suplemento, Ester-C®, contiene principalmente ascorbato de calcio e incluye pequeñas cantidades de metabolitos de la vitamina C, ácido deshidroascórbico (ácido ascórbico oxidado), treonato de calcio y cantidades mínimas de xilonato y lixonato. Si bien estos metabolitos pretenden aumentar la biodisponibilidad de la vitamina C, el único estudio publicado en humanos que abordó este problema no encontró diferencias entre el Ester-C® y los comprimidos de vitamina C disponibles comercialmente con respecto a la absorción y excreción urinaria de la vitamina C (187). El Ester-C® no debe confundirse con palmitato de ascorbilo, que también se comercializa como "éster de vitamina C" (véase más abajo).
Palmitato de ascorbilo
El palmitato de ascorbilo es un éster de vitamina C (es decir, ácido ascórbico unido a un ácido graso). En este caso, la vitamina C se esterifica al ácido graso saturado, el ácido palmítico, lo que resulta en una forma soluble en grasa de la vitamina C. Se ha agregado palmitato de ascorbilo a varias cremas para la piel debido al interés en sus propiedades antioxidantes, así como a su importancia en la síntesis de colágeno (188). Aunque el palmitato de ascorbilo también está disponible como un suplemento oral, la mayoría probablemente se hidroliza a ácido ascórbico y ácido palmítico en el tracto digestivo antes de que se absorba (189). El palmitato de ascorbilo se comercializa como "éster de vitamina C," que no debe confundirse con Ester-C® (véase arriba).
Otras formulaciones de vitamina C
Un pequeño ensayo, cruzado, controlado con placebo en 11 hombres mostró que la administración oral de 4 g de vitamina C resultó en una mayor concentración de vitamina C en plasma durante un período de cuatro horas cuando la vitamina C fue encapsulada en liposomas en comparación con la vitamina C no encapsulada (190). Aunque la encapsulación liposomal podría aumentar la biodisponibilidad de la vitamina C, las concentraciones de vitamina C en el plasma fueron mucho más bajas que las logradas con la administración intravenosa de vitamina C (190).
Para una revisión más detallada de la investigación científica sobre la biodisponibilidad de diferentes formas de vitamina C, véase La Disponibilidad de las Diferentes Formas de Vitamina C.
Seguridad
Toxicidad
Se han identificado varios posibles efectos adversos para la salud de dosis muy grandes de vitamina C, principalmente basados en experimentos in vitro o reportes de casos aislados, e incluyen mutaciones genéticas, defectos de nacimiento, cáncer, aterosclerosis, cálculos renales, "escorbuto de rebote," aumento del estrés oxidativo, exceso de absorción de hierro, deficiencia de vitamina B12 y erosión del esmalte dental. Sin embargo, ninguno de estos supuestos efectos adversos para la salud se han confirmado en estudios posteriores, y no existe evidencia científica confiable de que las dosis de vitamina C de hasta 10 g/día en adultos sean tóxicas o perjudiciales para la salud. La preocupación de la formación de cálculos renales con suplementos de vitamina C se discute abajo.
Con la última Ingesta Diaria Recomendada publicada en el 2000, se estableció por primera vez un nivel máximo de ingesta tolerable (NM) para la vitamina C (Tabla 4). Se recomendó un NM de 2 g (2,000 mg) diarios para evitar que los adultos generalmente sanos experimenten diarrea trastornos gastrointestinales (35). Estos síntomas generalmente no son graves, especialmente si se resuelven con la interrupción temporal de la suplementación con vitamina C.
| Grupo Etario | NM (mg/día) |
|---|---|
| Infantes 0-12 meses | No es posible establecer* |
| Niños 1-3 años | 400 |
| Niños 4-8 años | 650 |
| Niños 9-13 años | 1,200 |
| Adolescentes 14-18 años | 1,800 |
| Adultos 19 años y más | 2,000 |
| *La fuente de la ingesta debe provenir sólo de alimentos y fórmula. | |
Cálculos renales
Debido a que el oxalato es un metabolito de la vitamina C, existe cierta preocupación de que una ingesta alta de vitamina C podría aumentar el riesgo de cálculos renales de oxalato de calcio. Unos (24, 191, 192), pero no todos los estudios (193-195) han reportado que la vitamina C suplementaria aumenta las concentraciones de oxalato en la orina. Se ha examinado en varios estudios epidemiológicos si un aumento en los niveles de oxalato se traduciría a una elevación en el riesgo de cálculos renales. Dos grandes estudios de cohorte prospectivos, uno siguiendo a 42,251 hombres durante seis años y el otro siguiendo a 85,557 mujeres durante 14 años, reportaron que el consumo de ≥1,500 mg de vitamina C al día no aumentó el riesgo de formación de cálculos renales en comparación con los que consumían <250 mg a diario (196, 197). Por otro lado, otros dos estudios prospectivos grandes informaron que un alto consumo de vitamina C se asoció con un mayor riesgo de formación de cálculos renales en hombres (198, 199). Específicamente, el Estudio de Seguimiento de Profesionales de la Salud recolectó datos en la ingesta dietética y suplementaria de vitamina C cada cuatro años en 45,619 profesionales de la salud masculinos (40-75 años) (198). Después de 14 años de seguimiento, se encontró que los hombres que consumían ≥1,000 mg/día de vitamina C tenían un 41% mayor riesgo de cálculos renales en comparación con los hombres que consumían <90 mg de vitamina C a diario. En el estudio de Cohorte de Hombres Suecos, el uso autoinformado de suplementos de vitamina C con un solo nutriente (tomados siete o más veces por semana) en la base se asoció con un riesgo dos veces mayor de cálculos renales incidentes entre 48,840 hombres (edades 45-79 años) seguidos durante 11 años (199). A pesar de los resultados contradictorios, puede ser prudente que las personas predispuestas a la formación de cálculos renales con oxalato eviten la administración de suplementos de vitamina C en dosis altas.
Interacciones con drogas/fármacos
En general, la evidencia que sugiere que los medicamentos específicos pueden disminuir las concentraciones de vitamina C en la sangre en los seres humanos es limitada. Los bloqueadores de los canales de dihidropiridina del calcio (p. ej., nicardipina, nifedipina) pueden inhibir la captación de vitamina C por las células intestinales in vitro. Sin embargo, no se ha reportado ninguna reducción en las concentraciones de vitamina C en la sangre en humanos con estos medicamentos (200). La aspirina puede afectar el estatus de la vitamina C si se toma con frecuencia (201).
Al contrario, hay reportes de casos sugieren que la vitamina C suplementaria puede disminuir las concentraciones en la sangre de algunos medicamentos, como la flufenazina (el medicamento antipsicótico, Prolixin) y el indinavir (el medicamento antirretroviral, Crixivan) (200). Existe cierta evidencia, aunque controvertida, de que la vitamina C interactúa con medicamentos anticoagulantes como la warfarina (Coumadin). Las dosis grandes de vitamina C pueden bloquear la acción de la warfarina y, por lo tanto, disminuir su eficacia. Las personas que toman anticoagulantes deben limitar su ingesta de vitamina C a <1 g/día y su médico debe controlar su tiempo de protrombina después de la terapia con anticoagulantes (200). Además, la vitamina C puede unir el aluminio en el intestino y aumentar la absorción de compuestos que contienen aluminio (p. ej., antiácidos que contienen aluminio, aglutinantes de fosfato que contienen aluminio). Las personas con insuficiencia renal pueden estar en riesgo de toxicidad por aluminio cuando se toma vitamina C suplementaria al mismo tiempo que estos compuestos (200, 201). Finalmente, la vitamina C suplementaria puede aumentar las concentraciones de estrógeno en la sangre en mujeres que usan anticonceptivos o terapia de reemplazo hormonal (200).
El efecto potencial de los antioxidantes durante la quimioterapia no se conoce bien, pero es probable que sea un problema si un agente quimioterapéutico específico actúa a través de un mecanismo oxidativo, lo cual es poco común (171). No está claro si la vitamina C administrada por vía parenteral podría disminuir o aumentar la eficacia de los fármacos de quimioterapia — en particular, los agentes de alquilación (p. ej., ciclofosfamida, busulfán), antibióticos antitumorales (p. ej., doxorubicina, bleomicina), y trióxido de arsénico. Se recomienda a los pacientes que hablen con su oncólogo antes de usar los suplementos de vitamina C (200, 201).
Debido a que también se ha descubierto que las altas dosis de vitamina C interfieren con la interpretación de ciertas pruebas de laboratorio (p. ej., bilirrubina sérica, creatinina sérica y el análisis de guayaco en heces para detectar la sangre oculta), es importante informar a su proveedor de cuidado de la salud de cualquier reciente uso de suplemento.
Suplementos antioxidantes e inhibidores de la HMG-CoA reductasa (estatinas)
Un ensayo aleatorio controlado de tres años en 160 pacientes con enfermedad coronaria documentada y concentraciones bajas de HDL en la sangre descubrió que una combinación de simvastatina (Zocor) y niacina aumentó la concentración de HDL, inhibió la progresión de estenosis de las arterias coronarias (estrechamiento) y disminuyó la frecuencia de eventos cardiovasculares, tales como el infarto al miocardio y accidente cerebrovascular (202). Sorprendentemente, cuando se tomó una combinación de antioxidantes (1,000 mg de vitamina C, 800 UI de vitamina E, 100 μg de selenio y 25 mg de β-caroteno por día) con la combinación de simvastatina-niacina, se disminuyeron los efectos protectores. Dado que los antioxidantes se tomaron juntos en este ensayo, no se puede determinar la contribución individual de la vitamina C. En contraste, un ensayo mucho más grande en más de 20,000 hombres y mujeres con enfermedad coronaria o diabetes mellitus encontró que la simvastatina y una combinación de antioxidantes (600 mg de vitamina E, 250 mg de vitamina C y 20 mg de β-caroteno por día ) no disminuyeron los efectos cardioprotectores de la terapia con simvastatina durante un período de cinco años (203). Estos hallazgos contradictorios indican que se necesitan más investigaciones sobre las posibles interacciones entre los suplementos antioxidantes y los fármacos reductores de colesterol, tales como los inhibidores de la HMG-CoA reductasa (estatinas).
¿Promueve la vitamina C el daño oxidativo en condiciones fisiológicas?
Se sabe que la vitamina C funciona como un antioxidante altamente efectivo en organismos vivos. Sin embargo, en experimentos de laboratorio, la vitamina C puede interactuar con algunos iones de metal libres y conducir a la generación de radicales libres potencialmente dañinos. Aunque los iones de metal libres generalmente no se encuentran en condiciones fisiológicas, la idea de que altas dosis de vitamina C podrían promover el daño oxidativo in vivo ha recibido mucha atención. Se ha dado publicidad generalizada a algunos estudios que sugieren un efecto pro-oxidante de la vitamina C (204, 205), pero estos estudios resultaron ser defectuosos o sin relevancia fisiológica. Una revisión exhaustiva de la literatura no encontró alguna evidencia científica creíble de que la vitamina C suplementaria promueva el daño oxidativo en condiciones fisiológicas o en humanos (206).
Recomendación del Instituto Linus Pauling
La evidencia combinada de estudios metabólicos, farmacocinéticos y observacionales, y de ensayos aleatorios controlados apoya el consumo de suficiente vitamina C para alcanzar concentraciones plasmáticas de al menos 60 µmol/L. Si bien los adultos jóvenes generalmente sanos pueden alcanzar estas concentraciones plasmáticas con una ingesta diaria de al menos 200 mg/día, algunos individuos pueden tener una capacidad de absorción de vitamina C inferior a lo que se documenta actualmente. Por lo tanto, el Instituto Linus Pauling recomienda una ingesta de vitamina C de 400 mg al día para adultos para garantizar concentraciones tisulares repletas (29) — una cantidad sustancialmente mayor que la Ingesta Diaria Recomendada pero con un riesgo mínimo de efectos secundarios.
Esta recomendación se puede cumplir a través de los alimentos si la dieta incluye al menos varias porciones de frutas y verduras ricas en vitamina C (p. ej., frutas cítricas, kiwi, pimientos; véase Fuentes alimenticias) como parte de la ingesta diaria recomendada de frutas y verduras. La mayoría de los suplementos vitamínicos proporcionan al menos 60 mg de vitamina C.
Adultos mayores (>50 años)
Aún no se sabe con certeza si los adultos mayores tienen mayores requerimientos de vitamina C, sin embargo, se ha encontrado que algunas poblaciones mayores tienen ingestas de vitamina C considerablemente por debajo de la Ingesta Diaria Recomendada de 75 y 90 mg/día para mujeres y hombres, respectivamente (207). Una ingesta de vitamina C de al menos 400 mg al día puede ser particularmente importante para los adultos mayores que tienen un mayor riesgo de enfermedades crónicas relacionadas con la edad. Aún no se han realizado estudios farmacocinéticos en adultos mayores, pero hay cierta evidencia que sugiere que la eficiencia de uno de los mecanismos moleculares para la captación celular de vitamina C disminuye con la edad (208). Debido a que maximizar las concentraciones de la vitamina C en la sangre puede ser importante para proteger contra el daño oxidativo a las células y las moléculas biológicas, una ingesta de vitamina C de al menos 400 mg al día podría beneficiar a los adultos mayores que tienen un mayor riesgo de enfermedades crónicas causadas, en parte, por el daño oxidativo, tales como la enfermedad del corazón, accidente cerebrovascular, ciertos tipos de cáncer, y la catarata.
Autores y Críticos
Escrito originalmente en 2004 por:
Jane Higdon, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Noviembre 2002 por:
Jane Higdon, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Septiembre 2003 por:
Jane Higdon, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Diciembre 2004 por:
Jane Higdon, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Enero 2006 por:
Jane Higdon, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Septiembre 2009 por:
Victoria J. Drake, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Noviembre 2013 por:
Giana Angelo, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Julio 2018 por:
Barbara Delage, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Revisado en Diciembre 2018 por:
Anitra C. Carr, Ph.D.
Profesora Asociada de Investigación
Departamento de Patología y Ciencias Biomédicas
Universidad de Otago
Christchurch, Nueva Zelanda
Revisado en Diciembre 2018 por:
Alexander J. Michels, Ph.D.
Investigador Asociado
Instituto Linus Pauling
Universidad Estatal de Oregon
Traducido al Español en 2019 por:
Natsumi Then Shimazaki
Instituto Linus Pauling
Universidad Estatal de Oregon
Originalmente traducido al español en 2012 por Guillermo Sandoval y editado por Andrew Quest (Ph.D.) y Lisette Leyton (Ph.D.), todos provenientes de la Universidad de Chile. Estos esfuerzos fueron patrocinados por el projecto Anillo #ACT1111, CONICYT-Chile, programa PIA.
Derechos de autoría 2000-2021 Instituto Linus Pauling
Referencias:
1. Levine M, Padayatty SJ. Vitamin C. In: Ross AC, Caballero B, Cousins RJ, Tucker KL, Ziegler TR, eds. Modern Nutrition in Health and Disease, 11th ed. Baltimore, MD: Lippincott Williams & Wilkins; 2014:416-426.
2. Englard S, Seifter S. The biochemical functions of ascorbic acid. Annu Rev Nutr. 1986;6:365-406. (PubMed)
3 Camarena V, Wang G. The epigenetic role of vitamin C in health and disease. Cell Mol Life Sci. 2016;73(8):1645-1658. (PubMed)
4 Young JI, Zuchner S, Wang G. Regulation of the epigenome by vitamin C. Annu Rev Nutr. 2015;35:545-564. (PubMed)
5 Jariwalla RJ, Harakeh S. Antiviral and immunomodulatory activities of ascorbic acid. In: Harris JR, ed. Subcellular Biochemistry. Vol. 25. Ascorbic Acid: Biochemistry and Biomedical Cell Biology. New York: Plenum Press; 1996:215-231.
6 Kennes B, Dumont I, Brohee D, Hubert C, Neve P. Effect of vitamin C supplements on cell-mediated immunity in old people. Gerontology. 1983;29(5):305-310. (PubMed)
7 Panush RS, Delafuente JC, Katz P, Johnson J. Modulation of certain immunologic responses by vitamin C. III. Potentiation of in vitro and in vivo lymphocyte responses. Int J Vitam Nutr Res Suppl. 1982;23:35-47. (PubMed)
8 Prinz W, Bortz R, Bregin B, Hersch M. The effect of ascorbic acid supplementation on some parameters of the human immunological defence system. Int J Vitam Nutr Res. 1977;47(3):248-257. (PubMed)
9 Vallance S. Relationships between ascorbic acid and serum proteins of the immune system. Br Med J. 1977;2(6084):437-438. (PubMed)
10. Anderson R, Oosthuizen R, Maritz R, Theron A, Van Rensburg AJ. The effects of increasing weekly doses of ascorbate on certain cellular and humoral immune functions in normal volunteers. Am J Clin Nutr. 1980;33(1):71-76. (PubMed)
11. Levy R, Shriker O, Porath A, Riesenberg K, Schlaeffer F. Vitamin C for the treatment of recurrent furunculosis in patients with impaired neutrophil functions. J Infect Dis. 1996;173(6):1502-1505. (PubMed)
12. Bergsten P, Amitai G, Kehrl J, Dhariwal KR, Klein HG, Levine M. Millimolar concentrations of ascorbic acid in purified human mononuclear leukocytes. Depletion and reaccumulation. J Biol Chem. 1990;265(5):2584-2587. (PubMed)
13. Evans RM, Currie L, Campbell A. The distribution of ascorbic acid between various cellular components of blood, in normal individuals, and its relation to the plasma concentration. Br J Nutr. 1982;47(3):473-482. (PubMed)
14. Jariwalla RJ, Harakeh S. Mechanisms underlying the action of vitamin C in viral and immunodeficiency disease. In: Packer L, Fuchs J, eds. Vitamin C in Health and Disease. New York: Macel Dekker, Inc.; 1997:309-322.
15. Alberts B, Bray D, Lewis J, Raff M. Differentiated cells and the maintenance of tissues. Molecular Biology of the Cell. 3rd ed. New York: Garland Publishing, Inc.; 1994:1139-1193.
16. Pauling L. The immune system. How to Live Longer and Feel Better. 20th Anniversary ed. Corvallis: Oregon State University Press; 2006:105-111.
17. Dahl H, Degre M. The effect of ascorbic acid on production of human interferon and the antiviral activity in vitro. Acta Pathol Microbiol Scand B. 1976;84B(5):280-284. (PubMed)
18. Carr AC, Maggini S. Vitamin C and immune function. Nutrients. 2017;9(11). (PubMed)
19. Lykkesfeldt J, Poulsen HE. Is vitamin C supplementation beneficial? Lessons learned from randomised controlled trials. Br J Nutr. 2010;103(9):1251-1259. (PubMed)
20. Michels AJ, Frei B. Myths, artifacts, and fatal flaws: identifying limitations and opportunities in vitamin C research. Nutrients. 2013;5(12):5161-5192. (PubMed)
21. Johnston CS. Vitamin C. In: Erdman JWJ, Macdonald IA, Zeisel SH, eds. Present Knowledge in Nutrition. 10th ed. Ames, Iowa: Wiley-Blackwell; 2012:248-260.
22. Levine M, Padayatty SJ, Espey MG. Vitamin C: a concentration-function approach yields pharmacology and therapeutic discoveries. Adv Nutr. 2011;2(2):78-88. (PubMed)
23. Levine M, Wang Y, Padayatty SJ, Morrow J. A new recommended dietary allowance of vitamin C for healthy young women. Proc Natl Acad Sci U S A. 2001;98(17):9842-9846. (PubMed)
24. Levine M, Conry-Cantilena C, Wang Y, et al. Vitamin C pharmacokinetics in healthy volunteers: evidence for a recommended dietary allowance. Proc Natl Acad Sci U S A. 1996;93(8):3704-3709. (PubMed)
25. Padayatty SJ, Sun H, Wang Y, et al. Vitamin C pharmacokinetics: implications for oral and intravenous use. Ann Intern Med. 2004;140(7):533-537. (PubMed)
26. Carr AC, Bozonet SM, Pullar JM, Simcock JW, Vissers MC. Human skeletal muscle ascorbate is highly responsive to changes in vitamin C intake and plasma concentrations. Am J Clin Nutr. 2013;97(4):800-807. (PubMed)
27. Michels AJ, Hagen TM, Frei B. Human genetic variation influences vitamin C homeostasis by altering vitamin C transport and antioxidant enzyme function. Annu Rev Nutr. 2013;33:45-70. (PubMed)
28. Carr AC, Pullar JM, Bozonet SM, Vissers MC. Marginal ascorbate status (hypovitaminosis C) results in an attenuated response to vitamin C supplementation. Nutrients. 2016;8(6). (PubMed)
29. Frei B, Birlouez-Aragon I, Lykkesfeldt J. Authors' perspective: What is the optimum intake of vitamin C in humans? Crit Rev Food Sci Nutr. 2012;52(9):815-829. (PubMed)
30. Levine M, Rumsey SC, Daruwala R, Park JB, Wang Y. Criteria and recommendations for vitamin C intake. JAMA. 1999;281(15):1415-1423. (PubMed)
31. Lykkesfeldt J, Christen S, Wallock LM, Chang HH, Jacob RA, Ames BN. Ascorbate is depleted by smoking and repleted by moderate supplementation: a study in male smokers and nonsmokers with matched dietary antioxidant intakes. Am J Clin Nutr. 2000;71(2):530-536. (PubMed)
32. Sauberlich HE. A history of scurvy and vitamin C. In: Packer L, Fuchs J, eds. Vitamin C in health and disease. New York: Marcel Decker, Inc.; 1997:1-24.
33. Stephen R, Utecht T. Scurvy identified in the emergency department: a case report. J Emerg Med. 2001;21(3):235-237. (PubMed)
34. Weinstein M, Babyn P, Zlotkin S. An orange a day keeps the doctor away: scurvy in the year 2000. Pediatrics. 2001;108(3):E55. (PubMed)
35. Food and Nutrition Board, Institute of Medicine. Vitamin C. Dietary Reference Intakes for Vitamin C, Vitamin E, Selenium, and Carotenoids. Washington, D.C.: National Academy Press; 2000:95-185. (National Academy Press)
36. Schleicher RL, Carroll MD, Ford ES, Lacher DA. Serum vitamin C and the prevalence of vitamin C deficiency in the United States: 2003-2004 National Health and Nutrition Examination Survey (NHANES). Am J Clin Nutr. 2009;90(5):1252-1263. (PubMed)
37. Carr AC, Frei B. Toward a new recommended dietary allowance for vitamin C based on antioxidant and health effects in humans. Am J Clin Nutr. 1999;69(6):1086-1107. (PubMed)
38. Matsuzawa Y, Kwon TG, Lennon RJ, Lerman LO, Lerman A. Prognostic value of flow-mediated vasodilation in brachial artery and fingertip artery for cardiovascular events: a systematic review and meta-analysis. J Am Heart Assoc. 2015;4(11). (PubMed)
39. Ashor AW, Lara J, Mathers JC, Siervo M. Effect of vitamin C on endothelial function in health and disease: a systematic review and meta-analysis of randomised controlled trials. Atherosclerosis. 2014;235(1):9-20. (PubMed)
40. Forman JP, Choi H, Curhan GC. Fructose and vitamin C intake do not influence risk for developing hypertension. J Am Soc Nephrol. 2009;20(4):863-871. (PubMed)
41. Block G, Jensen CD, Norkus EP, Hudes M, Crawford PB. Vitamin C in plasma is inversely related to blood pressure and change in blood pressure during the previous year in young Black and White women. Nutr J. 2008;7:35. (PubMed)
42. Moran JP, Cohen L, Greene JM, et al. Plasma ascorbic acid concentrations relate inversely to blood pressure in human subjects. Am J Clin Nutr. 1993;57(2):213-217. (PubMed)
43. Myint PK, Luben RN, Wareham NJ, Khaw KT. Association between plasma vitamin C concentrations and blood pressure in the European prospective investigation into cancer-Norfolk population-based study. Hypertension. 2011;58(3):372-379. (PubMed)
44. Buijsse B, Jacobs DR, Jr., Steffen LM, Kromhout D, Gross MD. Plasma ascorbic acid, a priori diet quality score, and incident hypertension: a prospective cohort study. PLoS One. 2015;10(12):e0144920. (PubMed)
45. Juraschek SP, Guallar E, Appel LJ, Miller ER, 3rd. Effects of vitamin C supplementation on blood pressure: a meta-analysis of randomized controlled trials. Am J Clin Nutr. 2012;95(5):1079-1088. (PubMed)
46 Knekt P, Ritz J, Pereira MA, et al. Antioxidant vitamins and coronary heart disease risk: a pooled analysis of 9 cohorts. Am J Clin Nutr. 2004;80(6):1508-1520. (PubMed)
47. Ye Z, Song H. Antioxidant vitamins intake and the risk of coronary heart disease: meta-analysis of cohort studies. Eur J Cardiovasc Prev Rehabil. 2008;15(1):26-34. (PubMed)
48 Kubota Y, Iso H, Date C, et al. Dietary intakes of antioxidant vitamins and mortality from cardiovascular disease: the Japan Collaborative Cohort Study (JACC) study. Stroke. 2011;42(6):1665-1672. (PubMed)
49. Pfister R, Sharp SJ, Luben R, Wareham NJ, Khaw KT. Plasma vitamin C predicts incident heart failure in men and women in European Prospective Investigation into Cancer and Nutrition-Norfolk prospective study. Am Heart J. 2011;162(2):246-253. (PubMed)
50. Carter P, Gray LJ, Troughton J, Khunti K, Davies MJ. Fruit and vegetable intake and incidence of type 2 diabetes mellitus: systematic review and meta-analysis. BMJ. 2010;341:c4229. (PubMed)
51. Dehghan M, Akhtar-Danesh N, McMillan CR, Thabane L. Is plasma vitamin C an appropriate biomarker of vitamin C intake? A systematic review and meta-analysis. Nutr J. 2007;6:41. (PubMed)
52. Al-Khudairy L, Flowers N, Wheelhouse R, et al. Vitamin C supplementation for the primary prevention of cardiovascular disease. Cochrane Database Syst Rev. 2017;3:Cd011114. (PubMed)
53. Sesso HD, Buring JE, Christen WG, et al. Vitamins E and C in the prevention of cardiovascular disease in men: the Physicians' Health Study II randomized controlled trial. JAMA. 2008;300(18):2123-2133. (PubMed)
54. Roberts LJ, 2nd, Traber MG, Frei B. Vitamins E and C in the prevention of cardiovascular disease and cancer in men. Free Radic Biol Med. 2009;46(11):1558. (PubMed)
55. Hankey GJ. The global and regional burden of stroke. Lancet Glob Health. 2013;1(5):e239-240. (PubMed)
56. Tsivgoulis G, Safouris A, Kim DE, Alexandrov AV. Recent Advances in Primary and Secondary Prevention of Atherosclerotic Stroke. J Stroke. 2018;20(2):145-166. (PubMed)
57. Yokoyama T, Date C, Kokubo Y, Yoshiike N, Matsumura Y, Tanaka H. Serum vitamin C concentration was inversely associated with subsequent 20-year incidence of stroke in a Japanese rural community. The Shibata study. Stroke. 2000;31(10):2287-2294. (PubMed)
58. Myint PK, Luben RN, Welch AA, Bingham SA, Wareham NJ, Khaw KT. Plasma vitamin C concentrations predict risk of incident stroke over 10 y in 20 649 participants of the European Prospective Investigation into Cancer Norfolk prospective population study. Am J Clin Nutr. 2008;87(1):64-69. (PubMed)
59. Chen GC, Lu DB, Pang Z, Liu QF. Vitamin C intake, circulating vitamin C and risk of stroke: a meta-analysis of prospective studies. J Am Heart Assoc. 2013;2(6):e000329. (PubMed)
60. Ye Y, Li J, Yuan Z. Effect of antioxidant vitamin supplementation on cardiovascular outcomes: a meta-analysis of randomized controlled trials. PLoS One. 2013;8(2):e56803. (PubMed)
61. Bertoia M, Albanes D, Mayne ST, Mannisto S, Virtamo J, Wright ME. No association between fruit, vegetables, antioxidant nutrients and risk of renal cell carcinoma. Int J Cancer. 2010;126(6):1504-1512. (PubMed)
62. Heinen MM, Verhage BA, Goldbohm RA, van den Brandt PA. Intake of vegetables, fruits, carotenoids and vitamins C and E and pancreatic cancer risk in The Netherlands Cohort Study. Int J Cancer. 2012;130(1):147-158. (PubMed)
63. Roswall N, Olsen A, Christensen J, Dragsted LO, Overvad K, Tjonneland A. Micronutrient intake and risk of urothelial carcinoma in a prospective Danish cohort. Eur Urol. 2009;56(5):764-770. (PubMed)
64. Goodman M, Bostick RM, Kucuk O, Jones DP. Clinical trials of antioxidants as cancer prevention agents: past, present, and future. Free Radic Biol Med. 2011;51(5):1068-1084. (PubMed)
65. Zhang S, Hunter DJ, Forman MR, et al. Dietary carotenoids and vitamins A, C, and E and risk of breast cancer. J Natl Cancer Inst. 1999;91(6):547-556. (PubMed)
66. Michels KB, Holmberg L, Bergkvist L, Ljung H, Bruce A, Wolk A. Dietary antioxidant vitamins, retinol, and breast cancer incidence in a cohort of Swedish women. Int J Cancer. 2001;91(4):563-567. (PubMed)
67. Hutchinson J, Lentjes MA, Greenwood DC, et al. Vitamin C intake from diary recordings and risk of breast cancer in the UK Dietary Cohort Consortium. Eur J Clin Nutr. 2012;66(5):561-568. (PubMed)
68 Nagel G, Linseisen J, van Gils CH, et al. Dietary beta-carotene, vitamin C and E intake and breast cancer risk in the European Prospective Investigation into Cancer and Nutrition (EPIC). Breast Cancer Res Treat. 2010;119(3):753-765. (PubMed)
69. Roswall N, Olsen A, Christensen J, Dragsted LO, Overvad K, Tjonneland A. Micronutrient intake and breast cancer characteristics among postmenopausal women. Eur J Cancer Prev. 2010;19(5):360-365. (PubMed)
70. Liu C, Russell RM. Nutrition and gastric cancer risk: an update. Nutr Rev. 2008;66(5):237-249. (PubMed)
71. Mirvish SS, Wallcave L, Eagen M, Shubik P. Ascorbate-nitrite reaction: possible means of blocking the formation of carcinogenic N-nitroso compounds. Science. 1972;177(4043):65-68. (PubMed)
72. Tsugane S, Sasazuki S. Diet and the risk of gastric cancer: review of epidemiological evidence. Gastric Cancer. 2007;10(2):75-83. (PubMed)
73 Jenab M, Riboli E, Ferrari P, et al. Plasma and dietary vitamin C levels and risk of gastric cancer in the European Prospective Investigation into Cancer and Nutrition (EPIC-EURGAST). Carcinogenesis. 2006;27(11):2250-2257. (PubMed)
74. Banerjee S, Hawksby C, Miller S, Dahill S, Beattie AD, McColl KE. Effect of Helicobacter pylori and its eradication on gastric juice ascorbic acid. Gut. 1994;35(3):317-322. (PubMed)
75. Zhang ZW, Patchett SE, Perrett D, Katelaris PH, Domizio P, Farthing MJ. The relation between gastric vitamin C concentrations, mucosal histology, and CagA seropositivity in the human stomach. Gut. 1998;43(3):322-326. (PubMed)
76. Chuang CH, Sheu BS, Kao AW, et al. Adjuvant effect of vitamin C on omeprazole-amoxicillin-clarithromycin triple therapy for Helicobacter pylori eradication. Hepatogastroenterology. 2007;54(73):320-324. (PubMed)
77. Krajewska B, Brindell M. Urease activity and L-ascorbic acid. J Enzyme Inhib Med Chem. 2011;26(3):309-318. (PubMed)
78. Pal J, Sanal MG, Gopal GJ. Vitamin-C as anti-Helicobacter pylori agent: More prophylactic than curative- Critical review. Indian J Pharmacol. 2011;43(6):624-627. (PubMed)
79 Park Y, Spiegelman D, Hunter DJ, et al. Intakes of vitamins A, C, and E and use of multiple vitamin supplements and risk of colon cancer: a pooled analysis of prospective cohort studies. Cancer Causes Control. 2010;21(11):1745-1757. (PubMed)
80. Thompson CA, Cerhan JR. Fruit and vegetable intake and survival from non-Hodgkin lymphoma: does an apple a day keep the doctor away? Leuk Lymphoma. 2010;51(6):963-964. (PubMed)
81. Kabat GC, Kim MY, Wactawski-Wende J, Shikany JM, Vitolins MZ, Rohan TE. Intake of antioxidant nutrients and risk of non-Hodgkin's Lymphoma in the Women's Health Initiative. Nutr Cancer. 2012;64(2):245-254. (PubMed)
82. Wang L, Sesso HD, Glynn RJ, et al. Vitamin E and C supplementation and risk of cancer in men: posttrial follow-up in the Physicians' Health Study II randomized trial. Am J Clin Nutr. 2014;100(3):915-923. (PubMed)
83. Song Y, Xu Q, Park Y, Hollenbeck A, Schatzkin A, Chen H. Multivitamins, individual vitamin and mineral supplements, and risk of diabetes among older U.S. adults. Diabetes Care. 2011;34(1):108-114. (PubMed)
84. Harding AH, Wareham NJ, Bingham SA, et al. Plasma vitamin C level, fruit and vegetable consumption, and the risk of new-onset type 2 diabetes mellitus: the European prospective investigation of cancer--Norfolk prospective study. Arch Intern Med. 2008;168(14):1493-1499. (PubMed)
85. Donin AS, Dent JE, Nightingale CM, et al. Fruit, vegetable and vitamin C intakes and plasma vitamin C: cross-sectional associations with insulin resistance and glycaemia in 9-10 year-old children. Diabet Med. 2016;33(3):307-315. (PubMed)
86. Kositsawat J, Freeman VL. Vitamin C and A1c relationship in the National Health and Nutrition Examination Survey (NHANES) 2003-2006. J Am Coll Nutr. 2011;30(6):477-483. (PubMed)
87. Ashor AW, Werner AD, Lara J, Willis ND, Mathers JC, Siervo M. Effects of vitamin C supplementation on glycaemic control: a systematic review and meta-analysis of randomised controlled trials. Eur J Clin Nutr. 2017;71(12):1371-1380. (PubMed)
88. Rumbold A, Ota E, Nagata C, Shahrook S, Crowther CA. Vitamin C supplementation in pregnancy. Cochrane Database Syst Rev. 2015(9):Cd004072. (PubMed)
89. Balogun OO, da Silva Lopes K, Ota E, et al. Vitamin supplementation for preventing miscarriage. Cochrane Database Syst Rev. 2016(5):Cd004073. (PubMed)
90. Hammoud AO, Bujold E, Sorokin Y, Schild C, Krapp M, Baumann P. Smoking in pregnancy revisited: findings from a large population-based study. Am J Obstet Gynecol. 2005;192(6):1856-1862; discussion 1862-1853. (PubMed)
91. Kitsantas P, Christopher KE. Smoking and respiratory conditions in pregnancy: associations with adverse pregnancy outcomes. South Med J. 2013;106(5):310-315. (PubMed)
92. Milner AD, Rao H, Greenough A. The effects of antenatal smoking on lung function and respiratory symptoms in infants and children. Early Hum Dev. 2007;83(11):707-711. (PubMed)
93. Conde-Agudelo A, Althabe F, Belizan JM, Kafury-Goeta AC. Cigarette smoking during pregnancy and risk of preeclampsia: a systematic review. Am J Obstet Gynecol. 1999;181(4):1026-1035. (PubMed)
94. Abramovici A, Gandley RE, Clifton RG, et al. Prenatal vitamin C and E supplementation in smokers is associated with reduced placental abruption and preterm birth: a secondary analysis. Bjog. 2015;122(13):1740-1747. (PubMed)
95. McEvoy CT, Schilling D, Clay N, et al. Vitamin C supplementation for pregnant smoking women and pulmonary function in their newborn infants: a randomized clinical trial. JAMA. 2014;311(20):2074-2082. (PubMed)
96. McEvoy CT, Milner KF, Scherman AJ, et al. Vitamin C to Decrease the Effects of Smoking in Pregnancy on Infant Lung Function (VCSIP): Rationale, design, and methods of a randomized, controlled trial of vitamin C supplementation in pregnancy for the primary prevention of effects of in utero tobacco smoke exposure on infant lung function and respiratory health. Contemp Clin Trials. 2017;58:66-77. (PubMed)
97. Alzheimer's Association. 2018 Alzheimer's Disease Facts and Figures. Available at: https://www.alz.org/alzheimers-dementia/facts-figures. Accessed 6/22/18.
98. Dixit S, Bernardo A, Walker JM, et al. Vitamin C deficiency in the brain impairs cognition, increases amyloid accumulation and deposition, and oxidative stress in APP/PSEN1 and normally aging mice. ACS Chem Neurosci. 2015;6(4):570-581. (PubMed)
99. Kook SY, Lee KM, Kim Y, et al. High-dose of vitamin C supplementation reduces amyloid plaque burden and ameliorates pathological changes in the brain of 5XFAD mice. Cell Death Dis. 2014;5:e1083. (PubMed)
100. Bowman GL. Ascorbic acid, cognitive function, and Alzheimer's disease: a current review and future direction. Biofactors. 2012;38(2):114-122. (PubMed)
101. Harrison J, Rentz DM, McLaughlin T, et al. Cognition in MCI and Alzheimer's disease: baseline data from a longitudinal study of the NTB. Clin Neuropsychol. 2014;28(2):252-268. (PubMed)
102. Hansen SN, Tveden-Nyborg P, Lykkesfeldt J. Does vitamin C deficiency affect cognitive development and function? Nutrients. 2014;6(9):3818-3846. (PubMed)
103. Bowman GL, Dodge H, Frei B, et al. Ascorbic acid and rates of cognitive decline in Alzheimer's disease. J Alzheimers Dis. 2009;16(1):93-98. (PubMed)
104. Arlt S, Muller-Thomsen T, Beisiegel U, Kontush A. Effect of one-year vitamin C- and E-supplementation on cerebrospinal fluid oxidation parameters and clinical course in Alzheimer's disease. Neurochem Res. 2012;37(12):2706-2714. (PubMed)
105. Galasko DR, Peskind E, Clark CM, et al. Antioxidants for Alzheimer disease: a randomized clinical trial with cerebrospinal fluid biomarker measures. Arch Neurol. 2012;69(7):836-841. (PubMed)
106. Naeini AM, Elmadfa I, Djazayery A, et al. The effect of antioxidant vitamins E and C on cognitive performance of the elderly with mild cognitive impairment in Isfahan, Iran: a double-blind, randomized, placebo-controlled trial. Eur J Nutr. 2014;53(5):1255-1262. (PubMed)
107. Reiss GR, Werness PG, Zollman PE, Brubaker RF. Ascorbic acid levels in the aqueous humor of nocturnal and diurnal mammals. Arch Ophthalmol. 1986;104(5):753-755. (PubMed)
108. Tessier F, Moreaux V, Birlouez-Aragon I, Junes P, Mondon H. Decrease in vitamin C concentration in human lenses during cataract progression. Int J Vitam Nutr Res. 1998;68(5):309-315. (PubMed)
109. Wei L, Liang G, Cai C, Lv J. Association of vitamin C with the risk of age-related cataract: a meta-analysis. Acta Ophthalmol. 2016;94(3):e170-176. (PubMed)
110. Zheng Selin J, Rautiainen S, Lindblad BE, Morgenstern R, Wolk A. High-dose supplements of vitamins C and E, low-dose multivitamins, and the risk of age-related cataract: a population-based prospective cohort study of men. Am J Epidemiol. 2013;177(6):548-555. (PubMed)
111. Rautiainen S, Lindblad BE, Morgenstern R, Wolk A. Vitamin C supplements and the risk of age-related cataract: a population-based prospective cohort study in women. Am J Clin Nutr. 2010;91(2):487-493. (PubMed)
112. Mathew MC, Ervin AM, Tao J, Davis RM. Antioxidant vitamin supplementation for preventing and slowing the progression of age-related cataract. Cochrane Database Syst Rev. 2012(6):Cd004567. (PubMed)
113. Pastor-Valero M. Fruit and vegetable intake and vitamins C and E are associated with a reduced prevalence of cataract in a Spanish Mediterranean population. BMC Ophthalmol. 2013;13:52. (PubMed)
114. Zhu Y, Pandya BJ, Choi HK. Prevalence of gout and hyperuricemia in the US general population: the National Health and Nutrition Examination Survey 2007-2008. Arthritis Rheum. 2011;63(10):3136-3141. (PubMed)
115. Saag KG, Choi H. Epidemiology, risk factors, and lifestyle modifications for gout. Arthritis Res Ther. 2006;8 Suppl 1:S2. (PubMed)
116. Choi HK, Curhan G. Gout: epidemiology and lifestyle choices. Curr Opin Rheumatol. 2005;17(3):341-345. (PubMed)
117. Gao X, Curhan G, Forman JP, Ascherio A, Choi HK. Vitamin C intake and serum uric acid concentration in men. J Rheumatol. 2008;35(9):1853-1858. (PubMed)
118. Zheng Z, Harman JL, Coresh J, et al. The dietary fructose: vitamin C intake ratio is associated with hyperuricemia in African-American adults. J Nutr. 2018;148(3):419-426. (PubMed)
119. Choi HK, Gao X, Curhan G. Vitamin C intake and the risk of gout in men: a prospective study. Arch Intern Med. 2009;169(5):502-507. (PubMed)
120. Juraschek SP, Miller ER, 3rd, Gelber AC. Effect of oral vitamin C supplementation on serum uric acid: a meta-analysis of randomized controlled trials. Arthritis Care Res (Hoboken). 2011;63(9):1295-1306. (PubMed)
121. Stamp LK, Zhu X, Dalbeth N, Jordan S, Edwards NL, Taylor W. Serum urate as a soluble biomarker in chronic gout-evidence that serum urate fulfills the OMERACT validation criteria for soluble biomarkers. Semin Arthritis Rheum. 2011;40(6):483-500. (PubMed)
122. Stamp LK, O'Donnell JL, Frampton C, Drake JM, Zhang M, Chapman PT. Clinically insignificant effect of supplemental vitamin C on serum urate in patients with gout: a pilot randomized controlled trial. Arthritis Rheum. 2013;65(6):1636-1642. (PubMed)
123. Andres M, Sivera F, Falzon L, Buchbinder R, Carmona L. Dietary supplements for chronic gout. Cochrane Database Syst Rev. 2014(10):Cd010156. (PubMed)
124. Pocobelli G, Peters U, Kristal AR, White E. Use of supplements of multivitamins, vitamin C, and vitamin E in relation to mortality. Am J Epidemiol. 2009;170(4):472-483. (PubMed)
125. Roswall N, Olsen A, Christensen J, et al. Micronutrient intake in relation to all-cause mortality in a prospective Danish cohort. Food Nutr Res. 2012;56. (PubMed)
126. Harris HR, Orsini N, Wolk A. Vitamin C and survival among women with breast cancer: a meta-analysis. Eur J Cancer. 2014;50(7):1223-1231. (PubMed)
127. Bjelakovic G, Nikolova D, Gluud LL, Simonetti RG, Gluud C. Antioxidant supplements for prevention of mortality in healthy participants and patients with various diseases. Cochrane Database Syst Rev. 2012(3):Cd007176. (PubMed)
128. Khaw KT, Bingham S, Welch A, et al. Relation between plasma ascorbic acid and mortality in men and women in EPIC-Norfolk prospective study: a prospective population study. European Prospective Investigation into Cancer and Nutrition. Lancet. 2001;357(9257):657-663. (PubMed)
129. Goyal A, Terry MB, Siegel AB. Serum antioxidant nutrients, vitamin A, and mortality in U.S. Adults. Cancer Epidemiol Biomarkers Prev. 2013;22(12):2202-2211. (PubMed)
130. Basili S, Tanzilli G, Mangieri E, et al. Intravenous ascorbic acid infusion improves myocardial perfusion grade during elective percutaneous coronary intervention: relationship with oxidative stress markers. JACC Cardiovasc Interv. 2010;3(2):221-229. (PubMed)
131. Wang ZJ, Hu WK, Liu YY, et al. The effect of intravenous vitamin C infusion on periprocedural myocardial injury for patients undergoing elective percutaneous coronary intervention. Can J Cardiol. 2014;30(1):96-101. (PubMed)
132. Rodrigo R, Hasson D, Prieto JC, et al. The effectiveness of antioxidant vitamins C and E in reducing myocardial infarct size in patients subjected to percutaneous coronary angioplasty (PREVEC Trial): study protocol for a pilot randomized double-blind controlled trial. Trials. 2014;15:192. (PubMed)
133. Milei J, Forcada P, Fraga CG, et al. Relationship between oxidative stress, lipid peroxidation, and ultrastructural damage in patients with coronary artery disease undergoing cardioplegic arrest/reperfusion. Cardiovasc Res. 2007;73(4):710-719. (PubMed)
134. Lassnigg A, Punz A, Barker R, et al. Influence of intravenous vitamin E supplementation in cardiac surgery on oxidative stress: a double-blinded, randomized, controlled study. Br J Anaesth. 2003;90(2):148-154. (PubMed)
135. Spoelstra-de Man AME, Elbers PWG, Oudemans-van Straaten HM. Making sense of early high-dose intravenous vitamin C in ischemia/reperfusion injury. Crit Care. 2018;22(1):70. (PubMed)
136. Dingchao H, Zhiduan Q, Liye H, Xiaodong F. The protective effects of high-dose ascorbic acid on myocardium against reperfusion injury during and after cardiopulmonary bypass. Thorac Cardiovasc Surg. 1994;42(5):276-278. (PubMed)
137. Sisto T, Paajanen H, Metsa-Ketela T, Harmoinen A, Nordback I, Tarkka M. Pretreatment with antioxidants and allopurinol diminishes cardiac onset events in coronary artery bypass grafting. Ann Thorac Surg. 1995;59(6):1519-1523. (PubMed)
138. Ramos C, Brito R, Gonzalez-Montero J, et al. Effects of a novel ascorbate-based protocol on infarct size and ventricle function in acute myocardial infarction patients undergoing percutaneous coronary angioplasty. Arch Med Sci. 2017;13(3):558-567. (PubMed)
139. Valls N, Gormaz JG, Aguayo R, et al. Amelioration of persistent left ventricular function impairment through increased plasma ascorbate levels following myocardial infarction. Redox Rep. 2016;21(2):75-83. (PubMed)
140. Hemila H, Suonsyrja T. Vitamin C for preventing atrial fibrillation in high risk patients: a systematic review and meta-analysis. BMC Cardiovasc Disord. 2017;17(1):49. (PubMed)
141. Hu X, Yuan L, Wang H, et al. Efficacy and safety of vitamin C for atrial fibrillation after cardiac surgery: A meta-analysis with trial sequential analysis of randomized controlled trials. Int J Surg. 2017;37:58-64. (PubMed)
142. Polymeropoulos E, Bagos P, Papadimitriou M, Rizos I, Patsouris E, Tauoumpoulis I. Vitamin C for the prevention of postoperative atrial fibrillation after cardiac surgery: a meta-analysis. Adv Pharm Bull. 2016;6(2):243-250. (PubMed)
143. Lagowska-Lenard M, Stelmasiak Z, Bartosik-Psujek H. Influence of vitamin C on markers of oxidative stress in the earliest period of ischemic stroke. Pharmacol Rep. 2010;62(4):751-756. (PubMed)
144. Johansen JS, Harris AK, Rychly DJ, Ergul A. Oxidative stress and the use of antioxidants in diabetes: linking basic science to clinical practice. Cardiovasc Diabetol. 2005;4:5. (PubMed)
145. Balbi ME, Tonin FS, Mendes AM, et al. Antioxidant effects of vitamins in type 2 diabetes: a meta-analysis of randomized controlled trials. Diabetol Metab Syndr. 2018;10:18. (PubMed)
146. Khodaeian M, Tabatabaei-Malazy O, Qorbani M, Farzadfar F, Amini P, Larijani B. Effect of vitamins C and E on insulin resistance in diabetes: a meta-analysis study. Eur J Clin Invest. 2015;45(11):1161-1174. (PubMed)
147. Gillani SW, Sulaiman SAS, Abdul MIM, Baig MR. Combined effect of metformin with ascorbic acid versus acetyl salicylic acid on diabetes-related cardiovascular complication; a 12-month single blind multicenter randomized control trial. Cardiovasc Diabetol. 2017;16(1):103. (PubMed)
148. Levy AP, Friedenberg P, Lotan R, et al. The effect of vitamin therapy on the progression of coronary artery atherosclerosis varies by haptoglobin type in postmenopausal women. Diabetes Care. 2004;27(4):925-930. (PubMed)
149. Asleh R, Levy AP. Divergent effects of alpha-tocopherol and vitamin C on the generation of dysfunctional HDL associated with diabetes and the Hp 2-2 genotype. Antioxid Redox Signal. 2010;12(2):209-217. (PubMed)
150. Levy MM, Fink MP, Marshall JC, et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Crit Care Med. 2003;31(4):1250-1256. (PubMed)
151. Mann EA, Baun MM, Meininger JC, Wade CE. Comparison of mortality associated with sepsis in the burn, trauma, and general intensive care unit patient: a systematic review of the literature. Shock. 2012;37(1):4-16. (PubMed)
152. Carr AC, Rosengrave PC, Bayer S, Chambers S, Mehrtens J, Shaw GM. Hypovitaminosis C and vitamin C deficiency in critically ill patients despite recommended enteral and parenteral intakes. Crit Care. 2017;21(1):300. (PubMed)
153. Pravda J. Metabolic theory of septic shock. World J Crit Care Med. 2014;3(2):45-54. (PubMed)
154. Fowler AA, 3rd, Syed AA, Knowlson S, et al. Phase I safety trial of intravenous ascorbic acid in patients with severe sepsis. J Transl Med. 2014;12:32. (PubMed)
155. Zabet MH, Mohammadi M, Ramezani M, Khalili H. Effect of high-dose Ascorbic acid on vasopressor's requirement in septic shock. J Res Pharm Pract. 2016;5(2):94-100. (PubMed)
156. Marik PE, Khangoora V, Rivera R, Hooper MH, Catravas J. Hydrocortisone, vitamin C, and thiamine for the treatment of severe sepsis and septic shock: a retrospective before-after study. Chest. 2017;151(6):1229-1238. (PubMed)
157. Spoelstra-de Man AME, Elbers PWG, Oudemans-Van Straaten HM. Vitamin C: should we supplement? Curr Opin Crit Care. 2018;24(4):248-255. (PubMed)
158. Cameron E, Pauling L. Supplemental ascorbate in the supportive treatment of cancer: Prolongation of survival times in terminal human cancer. Proc Natl Acad Sci U S A. 1976;73(10):3685-3689. (PubMed)
159. Ohno S, Ohno Y, Suzuki N, Soma G, Inoue M. High-dose vitamin C (ascorbic acid) therapy in the treatment of patients with advanced cancer. Anticancer Res. 2009;29(3):809-815. (PubMed)
160. Chen Q, Espey MG, Krishna MC, et al. Pharmacologic ascorbic acid concentrations selectively kill cancer cells: action as a pro-drug to deliver hydrogen peroxide to tissues. Proc Natl Acad Sci U S A. 2005;102(38):13604-13609. (PubMed)
161. Chen Q, Espey MG, Sun AY, et al. Ascorbate in pharmacologic concentrations selectively generates ascorbate radical and hydrogen peroxide in extracellular fluid in vivo. Proc Natl Acad Sci U S A. 2007;104(21):8749-8754. (PubMed)
162. Chen Q, Espey MG, Sun AY, et al. Pharmacologic doses of ascorbate act as a prooxidant and decrease growth of aggressive tumor xenografts in mice. Proc Natl Acad Sci U S A. 2008;105(32):11105-11109. (PubMed)
163. Gao P, Zhang H, Dinavahi R, et al. HIF-dependent antitumorigenic effect of antioxidants in vivo. Cancer Cell. 2007;12(3):230-238. (PubMed)
164. Kuiper C, Molenaar IG, Dachs GU, Currie MJ, Sykes PH, Vissers MC. Low ascorbate levels are associated with increased hypoxia-inducible factor-1 activity and an aggressive tumor phenotype in endometrial cancer. Cancer Res. 2010;70(14):5749-5758. (PubMed)
165. Vissers MCM, Das AB. Potential mechanisms of action for vitamin C in cancer: reviewing the evidence. Front Physiol. 2018;9:809. (PubMed)
166. Carr AC, Cook J. Intravenous vitamin C for cancer therapy - identifying the current gaps in our knowledge. Front Physiol. 2018;9:1182. (PubMed)
167. Hoffer LJ, Levine M, Assouline S, et al. Phase I clinical trial of i.v. ascorbic acid in advanced malignancy. Ann Oncol. 2008;19(11):1969-1974. (PubMed)
168. Monti DA, Mitchell E, Bazzan AJ, et al. Phase I evaluation of intravenous ascorbic acid in combination with gemcitabine and erlotinib in patients with metastatic pancreatic cancer. PLoS One. 2012;7(1):e29794. (PubMed)
169 Riordan HD, Casciari JJ, Gonzalez MJ, et al. A pilot clinical study of continuous intravenous ascorbate in terminal cancer patients. P R Health Sci J. 2005;24(4):269-276. (PubMed)
170. Stephenson CM, Levin RD, Spector T, Lis CG. Phase I clinical trial to evaluate the safety, tolerability, and pharmacokinetics of high-dose intravenous ascorbic acid in patients with advanced cancer. Cancer Chemother Pharmacol. 2013;72(1):139-146. (PubMed)
171. Carr AC, Vissers MC, Cook JS. The effect of intravenous vitamin C on cancer- and chemotherapy-related fatigue and quality of life. Front Oncol. 2014;4:283. (PubMed)
172. Klingelhoeffer C, Kammerer U, Koospal M, et al. Natural resistance to ascorbic acid induced oxidative stress is mainly mediated by catalase activity in human cancer cells and catalase-silencing sensitizes to oxidative stress. BMC Complement Altern Med. 2012;12:61. (PubMed)
173. Hong SW, Lee SH, Moon JH, et al. SVCT-2 in breast cancer acts as an indicator for L-ascorbate treatment. Oncogene. 2013;32(12):1508-1517. (PubMed)
174. Fritz H, Flower G, Weeks L, et al. Intravenous vitamin C and cancer: a systematic review. Integr Cancer Ther. 2014;13(4):280-300. (PubMed)
175. Jacobs C, Hutton B, Ng T, Shorr R, Clemons M. Is there a role for oral or intravenous ascorbate (vitamin C) in treating patients with cancer? A systematic review. Oncologist. 2015;20(2):210-223. (PubMed)
176. Cabanillas F. Vitamin C and cancer: what can we conclude--1,609 patients and 33 years later? P R Health Sci J. 2010;29(3):215-217. (PubMed)
177. Pauling LC. Vitamin C and the Common Cold. San Francisco: W.H. Freeman; 1970.
178. Hemila H, Chalker E. Vitamin C for preventing and treating the common cold. Cochrane Database Syst Rev. 2013(1):Cd000980. (PubMed)
179. Hemila H. Vitamin C and common cold-induced asthma: a systematic review and statistical analysis. Allergy Asthma Clin Immunol. 2013;9(1):46. (PubMed)
180. Milan SJ, Hart A, Wilkinson M. Vitamin C for asthma and exercise-induced bronchoconstriction. Cochrane Database Syst Rev. 2013(10):Cd010391. (PubMed)
181. Cheng Y, Willett WC, Schwartz J, Sparrow D, Weiss S, Hu H. Relation of nutrition to bone lead and blood lead levels in middle-aged to elderly men. The Normative Aging Study. Am J Epidemiol. 1998;147(12):1162-1174. (PubMed)
182. Simon JA, Hudes ES. Relationship of ascorbic acid to blood lead levels. JAMA. 1999;281(24):2289-2293. (PubMed)
183. Lee DH, Lim JS, Song K, Boo Y, Jacobs DR, Jr. Graded associations of blood lead and urinary cadmium concentrations with oxidative-stress-related markers in the U.S. population: results from the third National Health and Nutrition Examination Survey. Environ Health Perspect. 2006;114(3):350-354. (PubMed)
184. Dawson EB, Evans DR, Harris WA, Teter MC, McGanity WJ. The effect of ascorbic acid supplementation on the blood lead levels of smokers. J Am Coll Nutr. 1999;18(2):166-170. (PubMed)
185. Abam E, Okediran BS, Odukoya OO, Adamson I, Ademuyiwa O. Reversal of ionoregulatory disruptions in occupational lead exposure by vitamin C. Environ Toxicol Pharmacol. 2008;26(3):297-304. (PubMed)
186. Carr AC, Vissers MC. Synthetic or food-derived vitamin C--are they equally bioavailable? Nutrients. 2013;5(11):4284-4304. (PubMed)
187. Johnston CS, Luo B. Comparison of the absorption and excretion of three commercially available sources of vitamin C. J Am Diet Assoc. 1994;94(7):779-781. (PubMed)
188. Austria R, Semenzato A, Bettero A. Stability of vitamin C derivatives in solution and topical formulations. J Pharm Biomed Anal. 1997;15(6):795-801. (PubMed)
189. DeRitter E, Cohen N, Rubin SH. Physiological availability of dehydro-L-ascorbic acid and palmitoyl-L-ascorbic acid. Science. 1951;113:628-631. (PubMed)
190. Davis JL, Paris HL, Beals JW, et al. Liposomal-encapsulated ascorbic acid: influence on vitamin C bioavailability and capacity to protect against ischemia-reperfusion injury. Nutr Metab Insights. 2016;9:25-30. (PubMed)
191. Massey LK, Liebman M, Kynast-Gales SA. Ascorbate increases human oxaluria and kidney stone risk. J Nutr. 2005;135(7):1673-1677. (PubMed)
192. Traxer O, Huet B, Poindexter J, Pak CY, Pearle MS. Effect of ascorbic acid consumption on urinary stone risk factors. J Urol. 2003;170(2 Pt 1):397-401. (PubMed)
193. Auer BL, Auer D, Rodgers AL. The effect of ascorbic acid ingestion on the biochemical and physicochemical risk factors associated with calcium oxalate kidney stone formation. Clin Chem Lab Med. 1998;36(3):143-147. (PubMed)
194. Liebman M, Chai WW, Harvey E, Boenisch L. Effect of supplemental ascorbate and orange juice on urinary oxalate. Nutr Res. 1997;17(3):415-425.
195. Wandzilak TR, D'Andre SD, Davis PA, Williams HE. Effect of high dose vitamin C on urinary oxalate levels. J Urol. 1994;151(4):834-837. (PubMed)
196. Curhan GC, Willett WC, Rimm EB, Stampfer MJ. A prospective study of the intake of vitamins C and B6, and the risk of kidney stones in men. J Urol. 1996;155(6):1847-1851. (PubMed)
197. Curhan GC, Willett WC, Speizer FE, Stampfer MJ. Intake of vitamins B6 and C and the risk of kidney stones in women. J Am Soc Nephrol. 1999;10(4):840-845. (PubMed)
198. Taylor EN, Stampfer MJ, Curhan GC. Dietary factors and the risk of incident kidney stones in men: new insights after 14 years of follow-up. J Am Soc Nephrol. 2004;15(12):3225-3232. (PubMed)
199. Thomas LD, Elinder CG, Tiselius HG, Wolk A, Akesson A. Ascorbic acid supplements and kidney stone incidence among men: a prospective study. JAMA Intern Med. 2013;173(5):386-388. (PubMed)
200. Natural Medicines. Vitamin C/Professional handout/Interactions with drugs. Available at: https://naturalmedicines.therapeuticresearch.com/. Accessed 7/2/18.
201. Hendler SS, Rorvik DM. PDR for Nutritional Supplements. 2nd ed. Montvale: Thomson Reuters; 2008.
202 Brown BG, Zhao XQ, Chait A, et al. Simvastatin and niacin, antioxidant vitamins, or the combination for the prevention of coronary disease. N Engl J Med. 2001;345(22):1583-1592. (PubMed)
203. Collins R, Peto R, Armitage J. The MRC/BHF Heart Protection Study: preliminary results. Int J Clin Pract. 2002;56(1):53-56. (PubMed)
204. Lee SH, Oe T, Blair IA. Vitamin C-induced decomposition of lipid hydroperoxides to endogenous genotoxins. Science. 2001;292(5524):2083-2086. (PubMed)
205. Podmore ID, Griffiths HR, Herbert KE, Mistry N, Mistry P, Lunec J. Vitamin C exhibits pro-oxidant properties. Nature. 1998;392(6676):559. (PubMed)
206. Carr A, Frei B. Does vitamin C act as a pro-oxidant under physiological conditions? Faseb J. 1999;13(9):1007-1024. (PubMed)
207. Brubacher D, Moser U, Jordan P. Vitamin C concentrations in plasma as a function of intake: a meta-analysis. Int J Vitam Nutr Res. 2000;70(5):226-237. (PubMed)
208. Michels AJ, Joisher N, Hagen TM. Age-related decline of sodium-dependent ascorbic acid transport in isolated rat hepatocytes. Arch Biochem Biophys. 2003;410(1):112-120. (PubMed)
Source: https://lpi.oregonstate.edu/es/mic/vitaminas/vitamina-C

0 Komentar